
- •Молекулярная физика.
- •Термодинамический подход к описанию молекулярных явлений.
- •Первое начало термодинамики. Циклические процессы
- •Второе начало термодинамики.
- •Энтропия термодинамической системы. Термодинамические потенциалы.
- •Взаимодействие молекул. Идеальный газ. Основные газовые законы.
- •1. Дискретный спектр энергий :
- •2. Распределение Гиббса.
- •3. Большое каноническое распределение (для ):
- •Теория флуктуаций. Броуновское движение.
- •Реальные газы. Уравнение Ван-дер-Ваальса.
- •Твердые тела. Кристаллы. Симметрия кристаллов.
- •Фазовые переходы первого и второго рода. Условия устойчивости и равновесия.
- •Явления переноса.
- •Кинетическое Уравнение Больцмана. Понятие об н-теореме Больцмана.
- •Плазменное состояние вещества. Уравнение Власова. Понятие о самосогласованном поле.
-
Молекулярная физика.
-
Термодинамический подход к описанию молекулярных явлений.
-
Температура
– количественная мера «нагретости»
тела. Температура является мерой
кинетической энергии тела. Измерение
«нагретости» сводится к измерению
характеристик тела, изменяющихся от
«нагретости». Тело, выбирающееся для
измерения «нагретости», называется
термометрическим, а величина, посредством
которой измеряют «нагретость» –
термометрической.
Температурой
называется числовое значение величины,
с помощью которой характеризуется
«нагретость» тела. Температура не
является сама по себе термометрической
величиной, которая взята за основу её
измерения. Она получается из термометрической
величины. Пусть
![]() и
и
![]() – термометрические величины замерзания
и кипения воды соответственно,
– термометрические величины замерзания
и кипения воды соответственно,
![]() и
и
![]() – температуры кипения и замерзания
воды. Градусом
температуры называется величина:
– температуры кипения и замерзания
воды. Градусом
температуры называется величина:
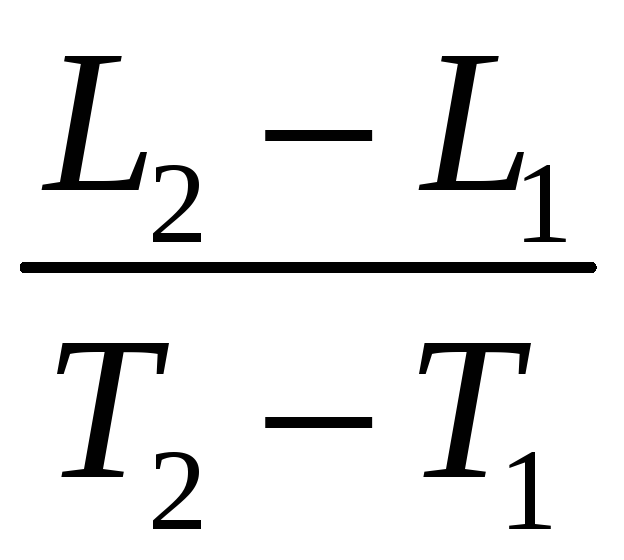 .
Температура термометрического тела
определяется по формуле:
.
Температура термометрического тела
определяется по формуле:
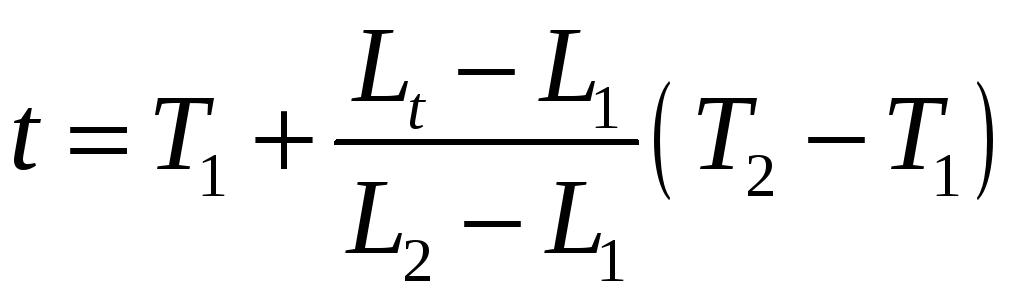 – эмпирическая
шкала
температур (шкала Цельсия, Фаренгейта,
Реомюра).
– эмпирическая
шкала
температур (шкала Цельсия, Фаренгейта,
Реомюра).
Газовый
термометр
– прибор, построенный на основе
разрежённого газа. Существует зависимость
![]() ,
которая легко считается для идеальных
газов.
,
которая легко считается для идеальных
газов.
Используя
законы Шарля и Гей-Люссака:
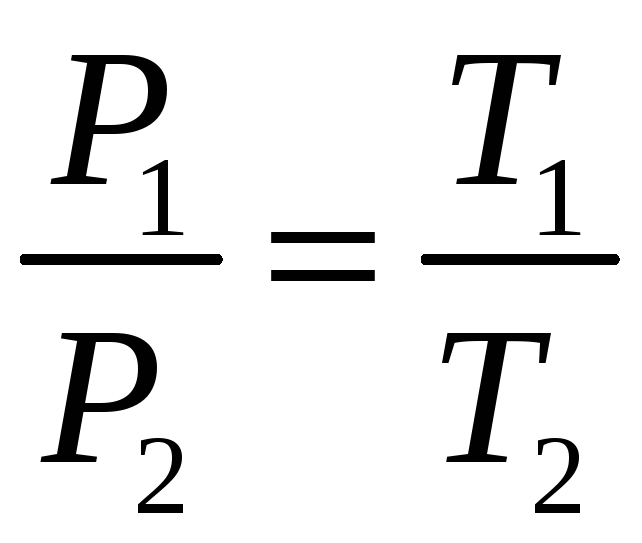 .
Для воды
.
Для воды
 .
.
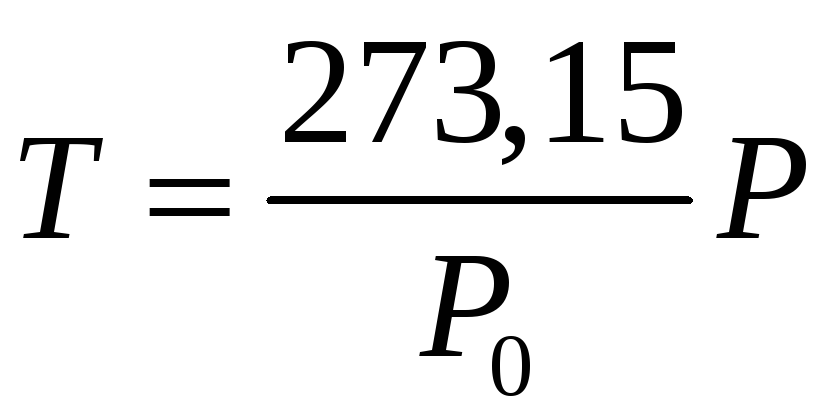 ,
где
,
где
![]() – давление газа при температуре тройной
точки,
– давление газа при температуре тройной
точки,
![]() – давление при измеряемой температуре.
Таким образом, переходим к абсолютной
шкале температур.
– давление при измеряемой температуре.
Таким образом, переходим к абсолютной
шкале температур.
a) Предмет молекулярной физики. б) Основные положения МКТ. в) Статистический Подход описанию молекулярных явлений. г) Понятие о статистических закономерностях.
а) Термодинамика и молекулярная физика изучают макроскопические процессы в телах, связанные с колоссальным количеством молекул и атомов. Молекулярная физика исходит из представления об атомно-молекулярном строении вещества и рассматривает теплоту как беспорядочное движение атомов и молекул. Рассматривает свойства и строение отдельных атомов и молекул.
б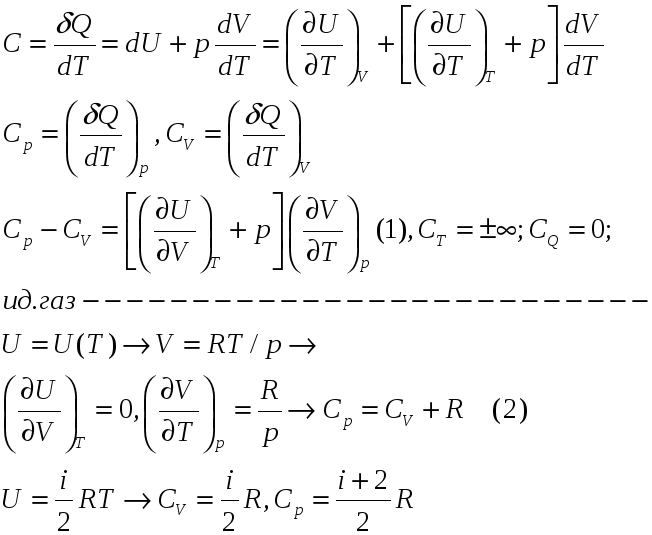 )
Газ разряжен, молекулы – упругие шарики
(материальные точки), обладающие только
кинетической энергией.
)
Газ разряжен, молекулы – упругие шарики
(материальные точки), обладающие только
кинетической энергией.
в) Для изучения системы многих частиц информация должна иметь обобщённый характер и относится не к отдельным частицам, а к совокупности большого числа частиц – статистический метод. Законы поведения совокупностей большого числа частиц, исследуемые статистическими методами, называются статистическими закономерностями.
г) Закономерности, обусловленные массовостью участвующих в их возникновении ингредиентов, называются статистическими, (бросание монеты).
а) Теплоёмкость системы. б) Теплоёмкость идеального газа в) Связь теплоёмкости газа с числом степеней свободы молекул. г) Уравнение Майера.
а)
Теплоёмкость
является характеристикой бесконечно
малого процесса, совершаемого телом.
![]() – функция состояния.
– функция состояния.
б)
Уравнение
![]() – уравнение
Майера,
выражает соотношение теплоёмкостей в
идеальном газе.
– уравнение
Майера,
выражает соотношение теплоёмкостей в
идеальном газе.
Термодинамический подход включает в себя следующие положения: термодинамика не вводит никаких специальных гипотез и конкретных представлений о строении вещества и физической природе теплоты. Ее выводы основаны на общих принципах, являющихся обобщением опытных фактов. Она рассматривает теплоту как внутреннее движение, но не пытается конкретизировать, что это за движение (ср. с билетом 1). Термодинамическое равновесие трудно поддается логическому определению. К нему приходят при рассмотрении конкретных реальных явлений последующего обобщения. Например: 2 тела при тепловом контакте в изолированной системе при разных температурах.
Квазистатические
процессы –
идеализированные процессы, состоящие
из непрерывно следующих друг за другом
состояний равновесия. Если в результате
какого-либо процесса система переходит
из состояния
![]() в другое состояние
в другое состояние
![]() и если возможно ее вернуть хотя бы одним
способом в исходное состояние
и если возможно ее вернуть хотя бы одним
способом в исходное состояние
![]() ,
притом так, чтобы во всех остальных
телах не произошло никаких изменений,
то процесс – обратимый,
иначе – необратимый.
Если способ возврата безразличен, то
процесс
обратимый в широком смысле слова,
а если через ту же последовательность,
то – в узком
смысле слова.
Квазистатические
процессы обратимы в узком смысле слова.
,
притом так, чтобы во всех остальных
телах не произошло никаких изменений,
то процесс – обратимый,
иначе – необратимый.
Если способ возврата безразличен, то
процесс
обратимый в широком смысле слова,
а если через ту же последовательность,
то – в узком
смысле слова.
Квазистатические
процессы обратимы в узком смысле слова.
