
1 сем / ФХ ДЗ 2
.docx

МИНОБРНАУКИ РОССИИ
Федеральное государственное бюджетное образовательное учреждение высшего образования
«МИРЭА – Российский технологический университет»
РТУ МИРЭА
|
|
Институт тонких химических технологий им. М.В. Ломоносова |
|
(наименование Института)
|
|
Кафедра физической химии им. Я.К. Сыркина |
|
(наименование кафедры)
Домашнее задание на тему:
«Диаграммы плавкости и кипения»
Работу выполнила
Студентка группы ХББО-02-16
Иванова Елена Анатольевна
Руководитель работы
Зобнина Аэлита Николаевна
Москва 2018
Вариант 9
Диаграмма плавкости
А ≡ RbCl
B ≡ SrCl2
|
T1, К |
а |
б |
в |
г |
д |
T2, К |
|
1073 |
35 |
85 |
5 |
35 |
85 |
923 |
-
На графике.
-
Состав химических соединений:
А ≡ RbCl 50%
B ≡ SrCl2 50%
С ≡ RbCl∙ SrCl2
-
Точки эвтектики = точки V на графике.
E1: Качественный состав: твердые В и С, их расплав.
Количественный состав: RbCl – 30%, SrCl2 – 70%
E2: Качественный состав: твердые А и С, их расплав.
Количественный состав: RbCl – 70%, SrCl2 – 30%
-
На графике.
-
При температуре Т1 = 1073 К и:
-
5% RbCl система содержит расплав RbCl и SrCl2 и твердые частицы SrCl2.
-
35% RbCl система находится в состоянии расплава RbCl и SrCl2.
-
85% RbCl система находится в состоянии расплава RbCl и SrCl2.
Если их охладить до T2 = 923 K, то система, содержащая:
-
5% RbCl останется в состоянии, содержащем расплав RbCl и SrCl2 и твердые частицы SrCl2.
-
35% RbCl будет содержать расплав RbCl и SrCl2 и выделится твердое химическое соединение С ≡ RbCl∙ SrCl2.
-
85% RbCl система будет состоять из твердого RbCl, находящегося в равновесии с расплавом.
-
Число фаз и степеней свободы при:
а) Т = 906 К (Е1) и 95% RbCl
Число фаз φ = 2 (твердое А + расплав L)
Число компонентов k = 2 (вещества А и В)
Число внешних факторов n = 1 (т.к. р = const)
Число термодинамических степеней свободы V=k+n-φ=2+1-2=1
Т = 827 К (Е2) и 95% RbCl
Число фаз φ = 3 (твердые А и С + расплав L)
Число компонентов k = 2 (вещества А и В)
Число внешних факторов n = 1 (т.к. р = const)
Число термодинамических степеней свободы V=k+n-φ=2+1-3=0
б) Т = 906 К (Е1) и 5% RbCl
Число фаз φ = 3 (твердые В и С + расплав L)
Число компонентов k = 2 (вещества А и В)
Число внешних факторов n = 1 (т.к. р = const)
Число термодинамических степеней свободы V=k+n-φ=2+1-3=0
Т = 827 К (Е2) и 5% RbCl
Число фаз φ = 2 (твердые В и С)
Число компонентов k = 2 (вещества А и В)
Число внешних факторов n = 1 (т.к. р = const)
Число термодинамических степеней свободы V=k+n-φ=2+1-2=1
-
При 5% RbCl плав начнет отвердевать при Т = 1120 К. При Т = 906 К плав отвердеет полностью. В процессе кристаллизации в твердую фазу переходит то вещество, которого в системе больше, т.е. SrCl2.
-
При 35% RbCl плав начнет плавиться при Т = 906 К. Полностью он расплавиться при Т = 940 К. Расплав первых капель будет содержать как RbCl, так и SrCl2.
-
Уравнение Шредера:
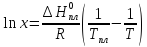
где x – мольная доля вещества в смеси;
ΔHпл – мольная теплота плавления чистого вещества;
Тпл – температура плавления чистого вещества;
Т – температура начала кристаллизации расплава с x.
RbCl: Тпл= 999 К, x = 0,9; Т = 960 К:
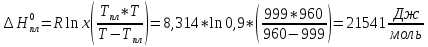
SrCl: Тпл(SrCl2) = 1147 К, x = 0,9; Т = 1124 К:
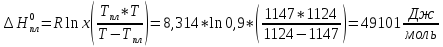
-
По правилу рычага:
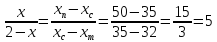
Откуда m (RbCl∙ SrCl2) = x = 1,7 кг.
Диаграмма кипения
|
T1 |
а |
б |
в |
|
333 |
25 |
27,1 |
72,9 |
А ≡ CH3OH
B ≡ CCl4
p = 10,133*104 Н/м3
-
На графике.
-
На графике.
-
Система, содержащая 25% CH3OH начнет кипеть при Т = 329 К, состав первого пузырька пара: 53% CH3OH и 47% CCl4. Последняя капля жидкости в данной системе исчезнет при Т=340,8 К и ее состав будет: 1% CH3OH и 99% CCl4.
-
Состав пара, находящегося в равновесии с жидкой бинарной системой, кипящей при Т1 = 333 К, зависит от состава исходного раствора. Рассмотрим два возможных случая:
-
Состав раствора: 5% CH3OH и 95% CCl4, тогда состав равновесного пара 43% CH3OH и 57% CCl4
-
Состав раствора: 93% CH3OH и 7% CCl4, тогда состав равновесного пара 78% CH3OH и 22% CCl4.
-
Для того, чтобы определить состав жидкой фазы бинарной системы, можно провести ректификацию до получения чистого компонента А или В. В зависимости от того, какой компонент выделится, по диаграмме кипения можно определить с какой стороны от азеотропной точки имеет место состав раствора при Т1 = 333 К.
-
Система содержит 27,1 кг CH3OH (М=32,04 г/моль) и 72,9 кг CCl4 (153,82 г/моль). Отсюда:
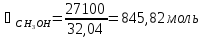
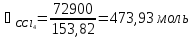
Мольная
доля компонента А:
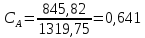
Следовательно, состав раствора лежит правее точки касания диаграмм. Раствор такого состава можно разделить на чистый метанол (компонент А) и азеотропный раствор данных веществ. Азеотроп состоит из 55% метанола и 45% тетрахлорметана, т.е. количество вещества А, остающегося в составе азеотропа:
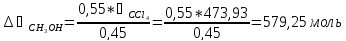
Или:
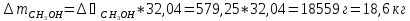
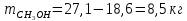
-
Азеотропный раствор содержит 45% тетрахлорметана, следовательно:

В исходном растворе присутствует 473,93 моль CCl4, поэтому необходимо добавить:
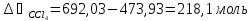
Или
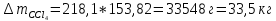
-
2 кг смеси, содержащей 25% CH3OH, нагревают до 333 К.
3СА=СВ, следовательно,
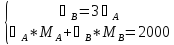
Откуда,
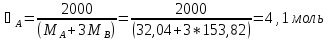
При температуре 333 К смесь, содержащая 25% CH3OH, имеет состав: 0,05 CH3OH и 0,95 CCl4 (жидкость) и 0,43 CH3OH и 0,57 CCl4 (пар). Отсюда:
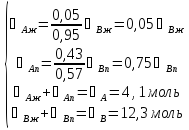
Решая данную систему, получаем:
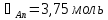
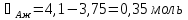
Умножаем все на МА:
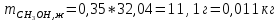
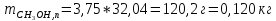
Таким образом, при температуре 333 К в жидкости будет находиться 0,011 кг метанола, а в паре – 0,12 кг.
