
- •«Физические основы электронной техники. Квантовая механика»
- •2. Движение микрочастицы в поле центральной
- •2.1. Поле центральной симметрии
- •2. 2. Атом водорода. Радиальная часть волновой функции
- •2.3. Схема уровней энергии и спектр атома водорода
- •2.4. Волновые функции атома водорода и распределение электронной плотности
- •2.5. Изотопический сдвиг и водородоподобные ионы
- •2.6. Энергетический спектр атомов щелочных металлов
2.4. Волновые функции атома водорода и распределение электронной плотности
Рассмотрим
детальнее квантовые состояния и
соответствующие собственные волновые
функции
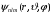 :
:
 .
(2.76)
.
(2.76)
Нормированные
волновые функции для некоторых состояний
водородоподобных атомов (для водорода
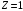 )
приведены в табл.2.1.
)
приведены в табл.2.1.
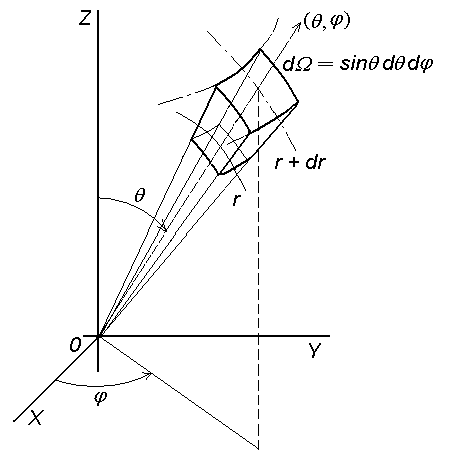
Квадрат
абсолютного значения
 представляет
вероятность того, что при определении
положения электрона в квантовом состоянии
представляет
вероятность того, что при определении
положения электрона в квантовом состоянии
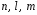 он будет найден в некотором объеме возле
точки с координатами
он будет найден в некотором объеме возле
точки с координатами
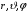 (рис. 2.2):
(рис. 2.2):
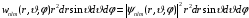 .
(2.77)
.
(2.77)
Обозначив
через
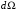 элемент телесного угла
элемент телесного угла
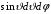 и используя формулы (2.3) и (2.55), запишем
вероятность в виде
и используя формулы (2.3) и (2.55), запишем
вероятность в виде
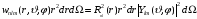 .
(2.78)
.
(2.78)
Интегрируя
по всем углам
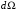 ,
мы получим вероятность найти электрон
между двумя сферами с радиусами
,
мы получим вероятность найти электрон
между двумя сферами с радиусами
 и
и
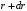 .
Обозначим эту вероятность через
.
Обозначим эту вероятность через
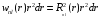 .
(2.79)
.
(2.79)
Таблица 2.1
|
n |
l |
m |
Нормируемая
|
Состояние |
|
1 |
0 |
0 |
|
1s |
|
2 |
0 |
0 |
|
2s |
|
2 |
1 |
0 |
|
2p |
|
1 |
|
|||
|
3
|
0 |
0 |
|
3s |
|
3 |
1 |
0 |
|
3p |
|
1 |
|
|||
|
3 |
2 |
0 |
|
3d |
|
1 |
|
|||
|
2 |
|
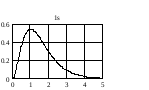
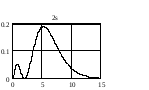
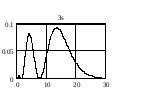
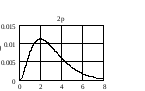
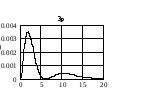
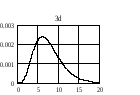
На
рис. 2.3 приведено распределение плотности
вероятности для различных состояний в
зависимости от расстояния
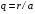 до
центра. Числа на кривых определяют
значение чисел
до
центра. Числа на кривых определяют
значение чисел
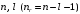 .
Из графиков можно видеть, что радиальное
квантовое число
.
Из графиков можно видеть, что радиальное
квантовое число
 определяет число узлов волновой функции
определяет число узлов волновой функции
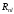 .
.
Выясним
теперь значение введенной выше длины
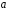 .
Для основного квантового состояния
(
.
Для основного квантового состояния
(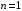 )
имеем
)
имеем
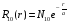 .
(2.80)
.
(2.80)
Следовательно,
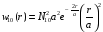 .
(2.81)
.
(2.81)
|
|
|
Рис.2.2. Сферические координаты |
|
Плотность вероятности |
|
|
|
|
|
|
|
|
|
Нормируемый радиус q=r/a |
|||
|
Рис.2.3. Распределение плотности вероятности для разных состояний атома водорода |
|||
Максимальное
значение этой вероятности имеет место
при
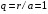 .
Отсюда следует, что в состоянии
.
Отсюда следует, что в состоянии
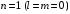 наиболее вероятно найти электрон при
наиболее вероятно найти электрон при
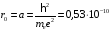 м
. (2.82)
м
. (2.82)
Это есть радиус первой орбиты Бора, величина которого впервые была получена Н.Бором из старой теории квантования.
Рассмотрим
теперь распределение по углам. Если
интегрировать по
 от 0 до
от 0 до
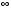 ,
то получим вероятность того, что электрон
находится в телесном угле
,
то получим вероятность того, что электрон
находится в телесном угле
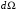 вокруг луча
вокруг луча
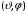 .
Воспользовавшись нормировкой (2.10) для
.
Воспользовавшись нормировкой (2.10) для
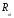 ,
получим
,
получим
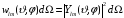 .
(2.83)
.
(2.83)
Из
вида функции
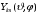 (2.20) следует, что вероятность не зависит
от угла
(2.20) следует, что вероятность не зависит
от угла
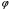 и равняется
и равняется
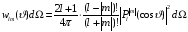 .
(2.84)
.
(2.84)
Следовательно,
распределение по углам имеет сферическую
симметрию. На рис.2.4 приведены полярные
диаграммы плотности вероятности
 для различных состояний
для различных состояний
 .
Величина
.
Величина
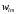 откладывается по радиус-вектору. При
откладывается по радиус-вектору. При
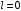 ,
,
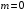 вероятность
вероятность
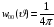 (2.85)
(2.85)
не
зависит от угла
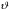 ,
и поэтому мы имеем сферическую симметрию.
Состояние, в котором момент импульса
равняется нулю (
,
и поэтому мы имеем сферическую симметрию.
Состояние, в котором момент импульса
равняется нулю (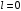 ),
называют s-состоянием,
соответствующий терм называют s-термом.
Это состояние характеризуется сферической
симметрией.
),
называют s-состоянием,
соответствующий терм называют s-термом.
Это состояние характеризуется сферической
симметрией.
Состояние
с
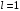 (
(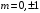 )
называют p-
состоянием, а
соответствующий терм –
p-термом. Вероятность
в этом случае определяется функциями
)
называют p-
состоянием, а
соответствующий терм –
p-термом. Вероятность
в этом случае определяется функциями
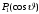 и
и
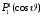 .
Воспользовавшись (2.16) и (2.17), получим из
(2.84)
.
Воспользовавшись (2.16) и (2.17), получим из
(2.84)
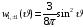 , (2.86)
, (2.86)
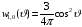 . (2.87)
. (2.87)
Состояние
с
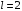 (
(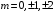 )
называют d-
состоянием,
а соответствующий терм –
d-термом.
Как и в предыдущем случае получим
)
называют d-
состоянием,
а соответствующий терм –
d-термом.
Как и в предыдущем случае получим
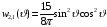 .
(2.88)
.
(2.88)
Вид
распределения вероятностей (рис.2.4)
позволяет нам получить некоторое
представление о форме атома в различных
состояниях. Эта форма определяется
значением орбитального числа
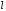 ,
а магнитное число
,
а магнитное число
 определяет ориентацию атома в пространстве.
определяет ориентацию атома в пространстве.
|
|
|
Рис.2.4.
Угловое распределение электронов
|


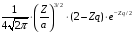
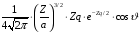
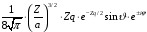

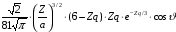
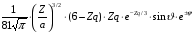
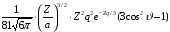
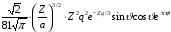
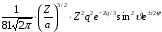
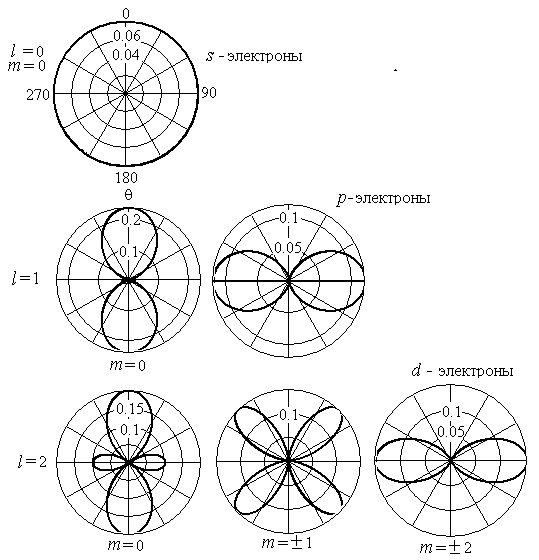
 для
s-,
p-
и
d-состояний.
для
s-,
p-
и
d-состояний.