Реальний газ
Реа́льний
газ — газ, для якого термічне рівняння
стану є відмінним від Клапейрона-Менделєєва.
На формі
залежностей між його параметрами
відбивається те, що молекули його
взаємодіють між собою та займають певний
об'єм.
Модель
реального газу
Стан реального
газу часто при вирішенні задач технічного
характеру описують узагальненим
рівнянням Клапейрона-Менделєєва
(технічним рівнянням стану реального
газу):
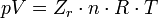
де p — тиск;
T — температура;
Zr = Zr (p,T) —
коефіцієнт стисливості газу;
R — універсальна
газова стала;
n — кількість
газу в молях,
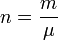 ( m — маса газу; μ — молярна маса газу);
( m — маса газу; μ — молярна маса газу);
Для ідеального
газу за будь-яких умов Z = 1, при якому
записане рівняння перетворюється у
рівняння стану ідеального газу. Для
реальних газів Z може істотно відрізнятися
від одиниці за певних умов, і завжди в
сильно розрідженому газі (р → 0 і ρ → 0)
в т. ч. і для реальних газів Z → 0.
Одна з
класичних моделей опису реального газу
— рівняння Ван дер Ваальса:
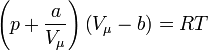 ,
,
де коефіцієнти
а і b називають сталими Ван дер Ваальса,
які залежать від хімічної природи
речовини, температури і тиску.
Рівняння Ван
дер Ваальса є наближеним рівнянням
стану реального газу, причому ступінь
його наближення різний для різних газів.
Записана велика кількість емпіричних
і напівемпіричних рівнянь стану реальних
газів (рівняння: Бертло[1], Клаузіуса —
Клапейрона, Дітерічі[2], Редліха -
Квонга[3], тощо). За рахунок збільшення
числа констант у цих рівняннях можна
досягти кращого узгодження з практикою,
порівняно з рівнянням Ван дер Ваальса.
Проте рівняння Ван дер Ваальса завдяки
своїй простоті та фізичному змісту
сталих a і b, що входять до нього, є
найпоширенішим для аналізу якісної
поведінки реальних газів.


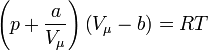 ,
,