
- •Комплексные соединения
- •Определение комплексных соединений
- •Основные понятия
- •Номенклатура комплексных соединений
- •Одноядерные комплексы
- •Классификация комплексных соединений
- •Катионные комплексы
- •Анионные комплексы
- •Нейтральные комплексы
- •Катионно-анионные комплексы
- •Циклические комплексы (хелаты)
- •Изомерия комплексных соединений
- •Ионизационная изомерия
- •Солевая изомерия
- •Координационная изомерия
- •Геометрическая изомерия (цис-, транс-изомерия)
- •Хлороамминдиэтилен диаминкобальта(III).
- •Природа химической связи в комплексных соединениях Метод валентных связей
- •Теория кристаллического поля
- •Теория поля лигандов
- •Свойства комплексных соединений Окраска комплексных соединений
- •Магнитные свойства комплексных соединений
- •Равновесия в растворах комплексных соединений
- •Устойчивость комплексных соединений
- •Кинетика и механизм реакций обмена лигандов
- •Кислотно - основные свойства комплексных соединений
- •Окислительно-восстановительные свойства комплексных соединений
- •Длины волн спектра и соответствующие им окраски
Теория поля лигандов
Хотя теория кристаллического поля основана на наглядных представлениях и даёт разумное объяснение спектральных и магнитных свойств некоторых комплексов, у неё есть и существенный недостаток. Рассматривая только электростатические взаимодействия, теория кристаллического поля полностью игнорирует ковалентный характер связи между металлом и лигандами.
Несмотря на успешное в ряде случаев использование этой теории для решения задач координационной химии, эта теория не позволяет объяснить многих важных явлений, связанных с комплексообразованием. В частности, нельзя объяснить закономерность изменения силы лигандов, фиксируемую спектрохимическим рядом. Нельзя также с точки зрения этой теории объяснить ряд явлений, связанных с ковалентным воздействием центрального иона и лигандов. Это подтверждается методами ЭПР, ЯМР, ИК-спектроскопии, электронной спектроскопии, магнетохимии, данными рентгеноструктурного анализа. Теория кристаллического поля не учитывает поляризационные эффекты, приводящие к возникновению ковалентных связей, вносящих очень значительный вклад в энергию взаимодействия центрального иона и лигандов.
Теория поля лигандов объединяет метод молекулярных орбиталей и теорию кристаллического поля: электростатическое воздействие поля лигандов на несвязывающие орбитали центрального атома-комплексообразователя, которое связано со стереохимией, магнитными свойствами и оптическим поглощением комплексов, а связи металл-лиганд можно рассматривать с точки зрения локализованных молекулярных орбиталей, образующихся из соответствующих атомных орбиталей. Особое значение в теории поля лигандов имеет возможность p-донорного и p- дативного взаимодействия.
Теория молекулярных орбиталей даёт подход, учитывающий ковалентный характер связей. Основные принципы теории молекулярных орбиталей, развитых в своё время для двухатомных молекул, применимы и к координационным соединениям. Для комплекса волновая функция молекулярной орбитали yмо представляет собой линейную комбинацию, состоящую из волновых функций орбитали центрального атома металла jм и групповой орбитали лигандов åсjL(линейная комбинация определённых орбиталей лигандов):
yмо =аjм ± båсjL
Знак + в уравнении отвечает связывающей орбитали, знак - разрыхляющей.
Рассмотрим октаэдрические комплексы d-элементов. Система координат взаимного расположения комплексообразователя и лигандов октаэдрического комплекса ML6 показана на рис.25 .
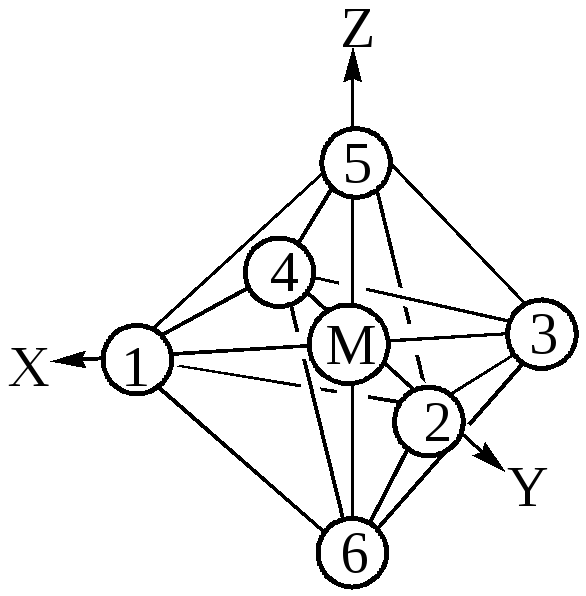
Рис.25. Схема октаэдрического комплекса ML6.
С учётом симметрии и энергетических соображений молекулярные орбитали(МО) строятся как линейная комбинация атомных орбиталей(АО). Могут образовываться как s -, так и p - молекулярные орбитали. Рассматривая связывание в октаэдрических комплексах, мы будем принимать во внимание в начале только s- взаимодействие. Металл (4 период) способен предоставить лигандам девять орбиталей: пять 3d, одну 4s и три 4р. Так,
s-орбиталь комплексообразователя благодаря сферической симметрии одинаково перекрывается с орбиталями каждого из шести лигандов, расположенных по осям октаэдра. Это приводит к образованию семицентровых связывающей и разрыхляющей молекулярных ss – орбиталей(ss и s*s). Каждая из трёх р-орбиталей может перекрываться с орбиталями лигандов, расположенных по осям x,y,z: px- орбиталь перекрывается только с орбиталями лигандов 1и 3, py- орбиталь – только с орбиталями лигандов 2и 4, pz- орбиталь – только с орбиталями лигандов 5 и 6. Это приводит к образованию трёхцентровых, трёх связывающих и трёх разрыхляющих sp -орбиталей(sx,sy,sz и sx*,sy*,sz*).Орбитали eg(sz2 и sx2-y2) перекрываются с орбиталями лигандов, соответствующим образом расположеннных в пространстве. При этом образуются две связывающие и две разрыхляющие молекулярные s-орбитали (sz2, sx2-y2 и sz2*и sx-2y2*).Орбитали t2g
(dxy,dyz,dxz ) не подходят для s-связывания, так как они не направлены к орбиталям лиганда. Орбитали t2g могут перекрываться по p - типу с теми орбиталями лигандов, которые обладают подходящей для этого симметрией. Многие лиганды (например, NH3, H2O, Cl-, Br-) не имеют таких орбиталей с энергией, близкой к энергии t2g- орбиталей центрального атома. Между такими лигандами и центральным атомом не образуется p- связей. Электроны, находящиеся на орбиталях t2g в комплексах, где отсутствуют p- связи, мало отличающиеся от их энергии в несвязанном атоме металла. Считается, что электроны, занимающие в свободном атоме металла орбитали dxy,dyz,dxz , при образовании комплекса переходят на несвязывающие молекулярные орбитали t2g, которые по энергии и форме электронных облаков мало отличаются от атомных орбиталей (их обозначение pxyo, pyzo, pxzo).
Октаэдрические комплексы в основном состоянии имеют семь энергетических уровней, три из которых связывающие, три- разрыхляющие и один – несвязывающий.
Рассмотрим с помощью этого метода электронную конфигурацию высокоспинового комплексного иона [CoF6]3- и низкоспинового иона [Co(NH3)6]3+. В образовании химической связи в этом комплексе участвуют 18 электронов: 6 электронов иона-комплексообразователя Co3+ и 12 электронов шести лигандов F-
(в высокоспиновом комплексном ионе) и шести лигандов NH3
(в низкоспиновом комплексном ионе). Молекулярные орбитали образуются в том случае, если атомные орбитали исходных взаимодействующих частиц близки по энергии и соответствующим образом ориентированы в пространстве. Орбиталь 4s иона Co3+ одинаково перекрывается с орбиталями каждого из шести лигандов, расположенных по осям октаэдра, в результате чего образуются связывающая и разрыхляющие молекулярные ss-орбитали:ss и ss*. Каждая из трёх 4р- орбиталей иона Co3+ перекрываются с орбиталями лигандов, так как последние расположены по осям р-орбиталей комплексообразователя. Это приводит к образованию шести sр- орбиталей: трёх связывающих sx , sy , sz и трёх разрыхляющих sx* ,sy*,sz*. Орбитали s(z2) и s(x2-y2) иона Co3+ перекрываются с орбиталями лигандов, соответствующим образом расположенных в пространстве. При этом образуются четыре молекулярные орбитали: две связывающие sz2,
s(x2-y2) и две разрыхляющие s(z2 )*, s(x2-y2)*. Орбитали dxy,dxz,dyz иона-комплексообразователя не направлены к орбиталям лигандов и не комбинируются с ними, поэтому не участвуют в образовании s-связи. Энергия этих орбиталей не изменяется, и они являются несвязывающими орбиталями. Их обозначение:
pxzо,pxyо ,pyzо .
Таким образом, в каждом из комплексных ионов [CoF6]3- и [Co(NH3)6]3+ пятнадцать молекулярных орбиталей: шесть связывающих, шесть разрыхляющих и три несвязывающих.18 валентных электронов в высокоспиновом комплексном ионе [CoF6]3- на молекулярных орбиталях располагаются следующим образом:
(ss )2,(sx)2,(sy)2,(sz)2,(sx2-y2)2,(sz2)2 / (pxzо)2,(pxyо)1,(pyzо)1 /
(s*x2-y2)1,(s*z2)1.
Схема образования молекулярных орбиталей в высокоспиновом комплексном ионе [CoF6]3- представлена диаграммой на рис.26.
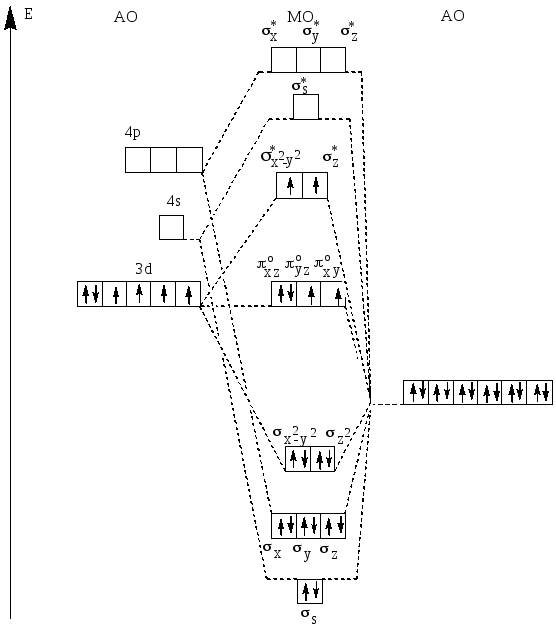
Рис.26. Схема распределения валентных электронов по молекулярным орбиталям октаэдрического высокоспинового комплекса [CoF6]3-.
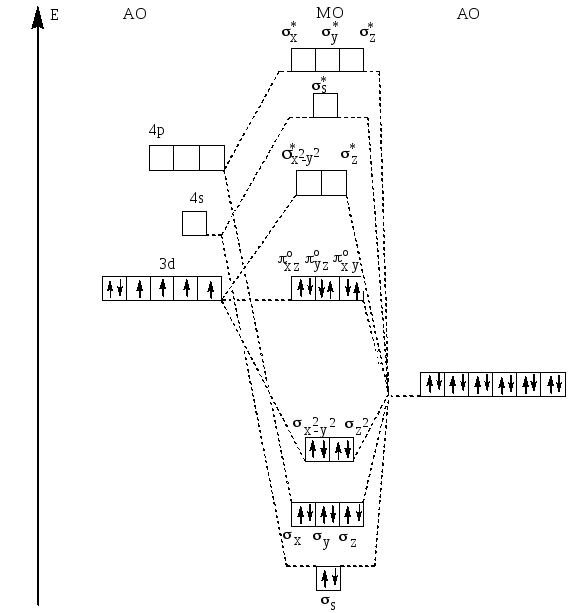
Рис.27. Схема распределения валентных электронов по молекулярным орбиталям октаэдрического низкоспинового комплексного иона [Co(NH3)6]3+.
Молекулярные орбитали oxy ,oxz, oyz и *x2-y2, *z2 в теории поля лигандов соответствуют dx2-y2 , dz2 и dxy, dxz, dyz – орбиталям, возникающих при расщеплении d - уровня в октаэдрическом поле лигандов. Таким образом, и в теории поля лигандов величина соответствует энергии электронного перехода между уровнями t2g и eg . В соответствии с рассматриваемой теорией растёт с увеличением степени перекрывания исходных орбиталей, которое приводит к увеличению энергетического различия между связывающими и разрыхляющими орбиталями, т.е. значение растёт с усилением - связывания металл-лиганд.
Однако, большинство лигандов способно к образованию не только -, но и - связей. Орбитали лигандов, способные к - перекрыванию, это р- и d- атомные орбитали или молекулярные и * - орбитали двухатомных молекул. По условиям симметрии t2g(dxy, dxz,dyz) – орбитали центрального атома могут комбинироваться с орбиталями лигандов с образованием молекулярных - орбиталей. В зависимости от того, заполнены или вакантны валентные орбитали лигандов, влияние образования - связей на величину оказывается прямо противоположным. Если заполненные уровни лигандов лежат значительно глубже валентных уровней металла, связывающие молекулярные орбитали комплекса будут формироваться на основе атомных орбиталей лигандов (например, галогенов или воды), а антисвязывающие – из орбиталей металла. В этом случае становится меньше значения, характерного для комплексов с одними лишь - связями. При образовании *- орбиталей комплекса некоторая часть электронной плотности от лигандов переносится к центральному атому. Такое - взаимодействие называется -донорно-акцепторным. Если вакантны уровни лигандов, лежащих выше заполненных валентных уровней металла, связывающие молекулярные орбитали комплекса, напротив, будут формироваться на основе орбиталей металла, а разрыхляющие молекулярные орбитали - на основе орбиталей лигандов. В результате, энергия несвязывающей t2g- орбитали центрального атома понижается, так как она превращается в связывающую молекулярную орбиталь. В этом случае становится больше значения, характерного для комплексов с одними лишь - связями. Тогда при образовании - орбиталей комплекса часть электронной плотности центрального атома переносится к лигандам. Такое взаимодействие называется
-дативным.
Лиганды, являющиеся- акцепторами, вызывают большее расщепление d- уровня; лиганды, являющиеся -донорами, наоборот, вызывают малое расщепление d- уровня. Именно поэтому лиганды начала спектрохимического ряда (галогены, Н2О), которые способны быть только -донорами, но не -акцепторами, создают слабое поле, а лиганды правой части ряда (СО,NO2-,CN-) проявляют свойства -акцепторов и, участвуя в -дативном взаимодействии, создают сильное поле. Такие комплексные соединения имеют большую устойчивость.
Физико-химические методы исследования карбонилов металлов, таких как [Fe(CO)5], [Ni(CO)4] и других, подтверждают наличие прочной -дативной связи металл-лиганд. Рентгеноэлектронная спектроскопия фиксирует на атоме металла положительный заряд, причиной которого является перенос электронов с центрального атома на разрыхляющие орбитали лиганда. В результате координации атомом металла прочность связи С-О уменьшается.
Следует также отметить, что хорошие -акцепторы, которые проявляют тенденцию к образованию комплексов с металлами в низкой степени окисления, так как при этом лиганду возвращается основная часть заряда, отданного металлу при образовании
- связей, повышают устойчивость комплексов металлов с низкими степенями окисления.
d-Элементы образуют также комплексы с молекулами органических соединений с - связями. В качестве примера можно привести соль Цейзе K[C2H4PtCl3], дибензолхром [Cr(C6H6)2] ферроцен [Fe(C5H5)2].
В анионе [Pt(- C2H4)Cl3]- соли Цейзе ион Pt2+ в сильном поле лигандов имеет dsp2- гибридизацию и образует, как правило, квадратные комплексы. Вакантная d- орбиталь Pt2+ перекрывается с заполненной электронами связывающей - орбиталью С2Н4 (донорно-акцепторная связь). (рис. 28).
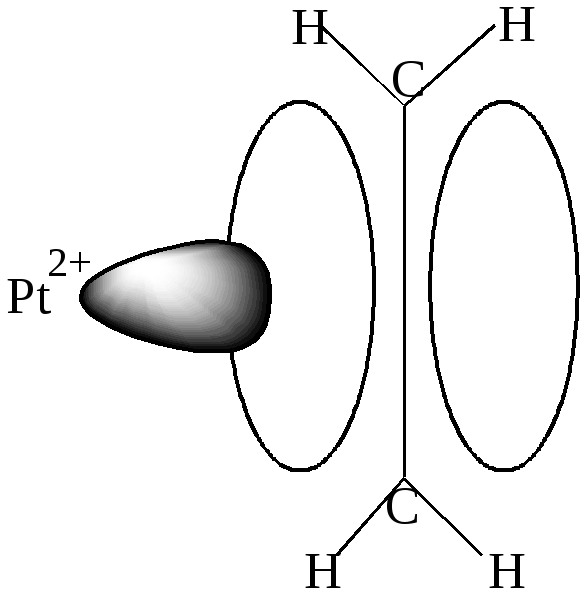
Рис. 28. Схема образования донорно-акцепторной связи
в этиленовом комплексе платины(II).
Перекрывание *- разрыхляющей вакантной орбитали С2Н4 – с заполненной двумя электронами d- орбиталью Pt2+ образует - дативную связь (рис.29). Таким образом, в подобных комплексах осуществляется кратная связь, что определяет их стабильность.
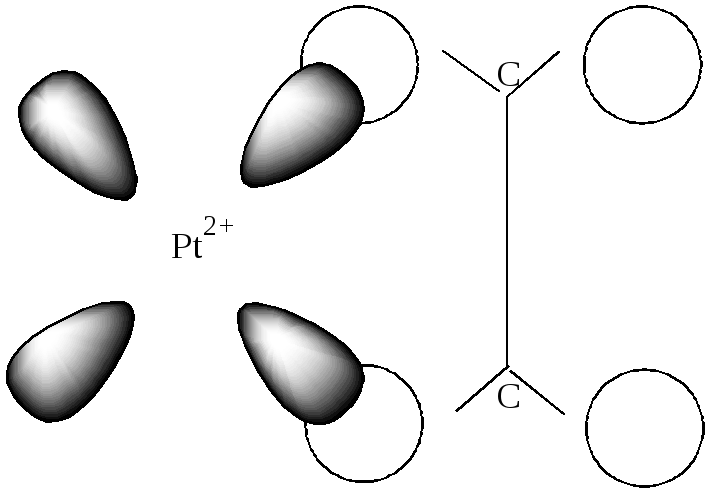
Рис. 29. Схема образования π-дативной связи в этиленовом
комплексе платины(II).
