II.Экспериментальная часть
Работа 1. Потенциометрический метод определения рН раствора (стр 124).
Цель работы: Познакомиться с устройством рН-метра. Приобрести навыки определения рН потенциометрическим методом.
рН-метр типа-рН-150М (в дальнейшем рН-метр] предназначен для измерения активности ионов водорода (рН), окислительно-восстановительных потенциалов (Eо) и температуры (tоС) водных растворов. Измерение рН, Eо и tо осуществляется в цифровой форме с помощью измерительного преобразователя и набора электродов.
рН-метр является портативным прибором с сетевым и автономным питанием и может быть применён в биохимических лабораториях (при определении рН желудочного сока), буферных растворов, концентрации мочевой кислоты и др.
Микростеклянные электроды с натриевой, калиевой и другими функциями служат для исследования процессов в клетках и тканях организма.
В основу работы рН-метра положен потенциометрический метод измерения рН и Eо контролируемого раствора.
При измерении рН (или Eh) и температуры растворов используется система, состоящая из измерительного и вспомогательного электродов.
В качестве измерительного электрода при измерении рН используется стеклянный или хингидронный электрод, а в качестве вспомогательного хлорсёребряный или каломельный электрод. В указанной марке оба электрода совмещены в комбинированный электрод
|
|
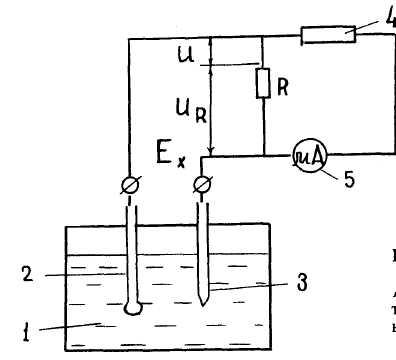
Рис. 2. Электроизмерительная схема рН-метра: 1- сосуд с раствором; 2 - индикаторный электрод; 3-электрод сравнения; 4 — усилитель; 5 – микроамперметр.
|
Р ис.
Стеклянный электрод
представляет собой трубку, заканчивающуюся
тонкостенной стеклянной мембраной в
виде шарика, чувствительной к определенному
виду ионов. Внутри находится раствор,
содержащий данный вид ионов, в который
опущен внутренний электрод сравнения,
соединяемый с внешней цепью. Чаще всего
используется стеклянный электрод,
чувствительный к ионам Н+
и поэтому позволяющий определить рН
раствора. В этом случае внутренним
раствором является 0,1 М
раствор НС1, а стеклянную
мембрану (шарик) изготавливают из
специального литийбарийсиликатного
стекла.
ис.
Стеклянный электрод
представляет собой трубку, заканчивающуюся
тонкостенной стеклянной мембраной в
виде шарика, чувствительной к определенному
виду ионов. Внутри находится раствор,
содержащий данный вид ионов, в который
опущен внутренний электрод сравнения,
соединяемый с внешней цепью. Чаще всего
используется стеклянный электрод,
чувствительный к ионам Н+
и поэтому позволяющий определить рН
раствора. В этом случае внутренним
раствором является 0,1 М
раствор НС1, а стеклянную
мембрану (шарик) изготавливают из
специального литийбарийсиликатного
стекла.
Р ис.
Хлорсеребряный
электрод
состоит из серебряной проволоки,
покрытой слоем малорастворимой соли
AgCl,
опущенной в раствор КС1 определенной
концентрации (обычно насыщенный
раствор КС1) и солевого мостика,
соединяющего этот раствор с
исследуемым раствором. Электрохимическая
цепь хлорсеребряного
электрода записывается так: Ag|AgCl,КС1(нас).
ис.
Хлорсеребряный
электрод
состоит из серебряной проволоки,
покрытой слоем малорастворимой соли
AgCl,
опущенной в раствор КС1 определенной
концентрации (обычно насыщенный
раствор КС1) и солевого мостика,
соединяющего этот раствор с
исследуемым раствором. Электрохимическая
цепь хлорсеребряного
электрода записывается так: Ag|AgCl,КС1(нас).
Так как активность твердых веществ AgCl и Ag постоянна, то потенциал хлорсеребряного электрода зависит только от активности ионов С1- в растворе. Если активность ионов С1- поддерживать постоянной (используют насыщенный р-р КС1), то и потенциал хлорсеребряного электрода будет постоянной величиной.
Потенциал хлорсеребряного электрода постоянен, легко воспроизводим и практически не зависит от протекания побочных реакций.
Работа 2. ОПРЕДЕЛЕНИЕ КОНСТАНТЫ ДИССОЦИАЦИИ И КОНЦЕНТРАЦИИ УКСУСНОЙ КИСЛОТЫ В РАСТВОРЕ
Цель работы. Определить концентрацию раствора уксусной кислоты и рассчитать константу диссоциации уксусной кислоты.
Методика. Отберите пипеткой 10 мл СН3СООН в стакан для титрования и добавьте дистиллированной воды до полного смачивания раствором шарика стеклянного электрода. Титрование проводите раствором натрий гидроксида, приливая из бюретки по 0,5 мл (*лучше 1 мл) щелочи и каждый раз фиксируя значение рН по шкале рН-метра (при приливании щелочи осторожно перемешивайте содержимое стакана для более точного замера рН). Титрование проведите до значения рН 12—13.
Вопросы:
-
Постройте по полученным данным интегральную кривую в координатах рН — VNaOH, мл.
-
Отметьте на графике рН в точке эквивалентности и точку полунейтрализации.
-
Используя уравнение Гендорсона – Хассельбаха:
-
 (при α = 0,5), определите
графически Еk для СН3СООН,
сравните с табличным значением.
(при α = 0,5), определите
графически Еk для СН3СООН,
сравните с табличным значением.
-
Рассчитайте молярную концентрацию уксусной кислоты в растворе, используя закон эквивалентов. Сделайте вывод.
-
Составьте схему химической цепи гальванического элемента, лежащего в основе работы рН-метра.

Рис. Кривая потенциометрического титрования СН3СООН щелочью.