
- •I . Борівська теорія атома
- •1.1. Закономірність в атомних спектрах
- •1.2. Модель атома Томсона
- •1.3. Досліди по розсіянню -частинок. Ядерна модель атома
- •1.4. Постулати Бора. Дослід Франка і Герца
- •1.5. Елементарна борівська теорія водневого атома
- •II. Елементи квантової механіки
- •2.1. Гіпотеза Луї де Бройля. Корпускулярно-хвильовий дуалізм
- •2.2. Співвідношення невизначеностей Гейзенберга
- •2.3. Рівняння Шредінгера
- •2.4. Фізичний зміст псі-функції
- •2.5. Квантування енергії
- •2.6. Рух вільної частинки
- •2.7. Частинка в нескінченно глибокій потенціальній ямі
- •2.8. Гармонічний осцилятор
- •2.9. Проходження частинки крізь потенціальний бар’єр
- •2.10. Квантування моменту імпульсу
- •III. Квантова теорія атомів і молекул
- •3.1. Квантова теорія атома водню
- •3.2. Багатоелектронні атоми
- •3.2.1. Спектри лужних металів
- •3.2.2. Нормальний ефект Зеємана
- •3.2.3 Мультиплетність спектрів і спін електрона
- •3.2.4 Механічний та магнітний моменти багатоелектонного атома
- •3.2.5. Розподіл електронів в атомі за станами. Періодична система елементів д.І. Менделєєва
- •3.2.6. Рентгенівські спектри
- •3.2.7. Енергія молекули
- •3.2.8. Молекулярні спектри
- •3. 2. 9 Комбінаційне розсіювання світла
- •3. 2.10. Вимушене випромінювання. Лазери
- •I. Борівська теорія атома………………………………………………………..…3
1.4. Постулати Бора. Дослід Франка і Герца
Правильні висновки з труднощів моделі атома Резерфорда зробив датський фізик Н.Бор у 1913р. Він не відкидав самої моделі атома, оскільки вона ґрунтувалась на дослідних даних, але зробив сміливе припущення про те, що в мікроструктурі атома закони класичної електродинаміки не справджуються і що для з’ясування внутрішнього механізму атома слід керуватися ідеєю квантової теорії випромінювання Планка. Як відомо, таких висновків Н.Бор дійшов у результаті аналізу лінійчастих спектрів атомів.
У пошуках загальної квантової теорії, яка б відбивала внутрішній механізм ядерної моделі атома і пояснювала спектральні закономірності випромінювання, Н.Бор сформулював два постулати.
1.
Атому
властиві цілком стійкі стани з певними
значеннями енергії ![]() ,
у разі перебування в яких він не поглинає
і не випромінює електромагнітних хвиль
навіть при взаємному русі заряджених
складових частинок. Ці стани були названі
стаціонарними станами атома.
,
у разі перебування в яких він не поглинає
і не випромінює електромагнітних хвиль
навіть при взаємному русі заряджених
складових частинок. Ці стани були названі
стаціонарними станами атома.
Оскільки кожне з дискретного ряду значення енергії залежить від перебування електронів у ньому на тих чи інших орбітах, то з постулату випливає, що електрони в атомі можуть перебувати лише на цілком певних орбітах, які відповідають стаціонарним станам атома. Тому інакше перший постулат Бора можна сформулювати так:
електрони можуть рухатись в атомі тільки по цілком певних орбітах, перебуваючи на яких вони не випромінюють і не поглинають енергії, хоча їхні рухи при цьому прискоренні.
Ці орбіти відповідають стаціонарним станам електронів в атомі. Вони визначаються співвідношенням
![]() (n=1,
2, 3 …),
(1.11)
(n=1,
2, 3 …),
(1.11)
де - момент імпульсу електрона на орбіті; n – номер відповідної орбіти; h – стала Планка.
2. У разі переходу з одного стаціонарного стану в другий атоми випромінюють або поглинають електромагнітні хвилі тільки цілком певної частоти, яку визначають за умовою
![]() ,
(1.12)
,
(1.12)![]()
де
і
![]() - енергія атома в першому і другому
стаціонарних станах.
- енергія атома в першому і другому
стаціонарних станах.
Інакше кажучи, атом випромінює або поглинає квант електромагнітної енергії в результаті перестрибування електрона з однієї стаціонарної орбіти на іншу.
Другий постулат Бора називають умовою частот, оскільки він визначає частоту можливого випромінювання або поглинання атома.
Наявність дискретних енергетичних рівнів енергії атома підтвердили експериментально Франк і Герц в 1914р, досліджуючи залежність анодного струму I від прискорюючої напруги U між електродами в трубці з парою ртуті за тиску ~ 1 мм. рт. ст. (рис. 1.3), де 1 – трьохелектродна електрона лампа з парою ртуті; k – катод; A – анод; C – сітка; П – потенціометр для зміни величини напруги U.
М
Рис.
1.3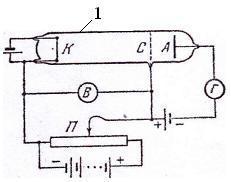 іж
сіткою і анодом створено слабке
електричне
поле (різниця потенціалів ~ 0,5 В),
що
гальмує
рух «слабких» електронів до аноду. На
рис. 1.4 показана зміна потенціальної
енергії електрона на
іж
сіткою і анодом створено слабке
електричне
поле (різниця потенціалів ~ 0,5 В),
що
гальмує
рух «слабких» електронів до аноду. На
рис. 1.4 показана зміна потенціальної
енергії електрона на ![]() в зазорі між електродами за різних
значень напруги U між електродами.
в зазорі між електродами за різних
значень напруги U між електродами.
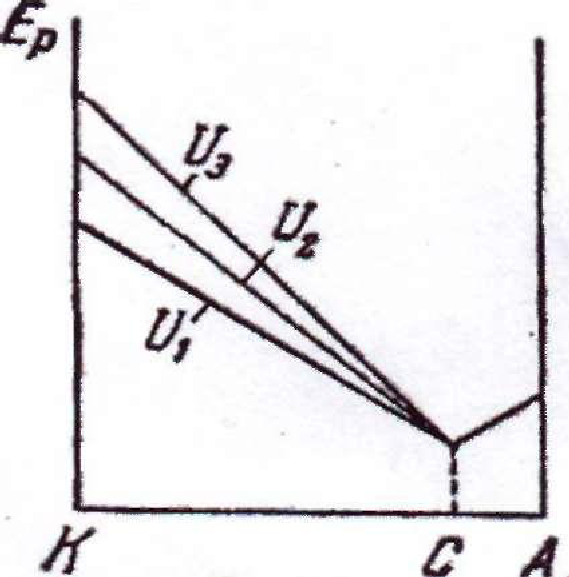
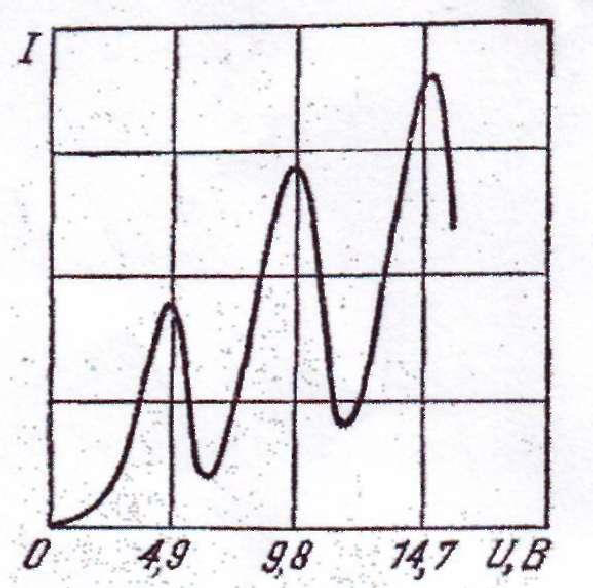
Рис. 1.4 Рис. 1.5
Із рис. 1.5 видно, що сила струму спочатку монотонна зростала, досягаючи максимального значення за напруги U=4,9 B, після чого з подальшим збільшенням U різко зменшувалась, досягаючи мінімуму, і знову починала зростати. Максимуми сили струму повторювались при напругах 9,8 , 14,7 В і т.д.
Такий хід кривої пояснюється тим, що внаслідок дискретності енергетичних рівнів атоми ртуті можуть поглинати енергію тільки порціями:
![]() або і т.д.,
або і т.д.,
де
![]() - енергії 1-го, 2-го, 3-го, і т.д. стаціонарних
станів.
- енергії 1-го, 2-го, 3-го, і т.д. стаціонарних
станів.
До тих пір, доки енергія електрона є меншою , зіткнення між електроном і атомами ртуті є пружним, і оскільки маса електрона набагато менша маси атома ртуті, то енергія електрона при зіткненні не змінюється. Частина електронів попадає на сітку, інші, проскочивши сітку, досягають анода, створюючи струм в мережі гальванометра Г. Чим більша швидкість, з якою електрони досягають сітки (чим більша напруга U), тим більшою буде доля електронів, що досягають атома, а, отже, і більшою буде сила струму I.
Коли енергія, накопичена електроном в проміжку між катодом і сіткою, досягає значення , зіткнення перестають бути пружними – електрон передає атому ртуті енергію і продовжує рухатися з меншою швидкістю. Тому число електронів , що досягають анода, зменшується. Наприклад, при U=5,3 В електрон передає атому ртуті енергію, що відповідає значенню напруги 4,9 В (перший потенціал збудження атома ртуті) і продовжує рухатись з енергією 0,4 еВ. Якщо навіть такий електрон опиниться між сіткою і анодом, він не зможе покорити різницю потенціалів 0,5 В і повернеться на сітку.
Атоми,
які отримали від електронів енергію ,
переходять у збуджений стан, із якого
вони через час ~ 10-8
с
повертаються в основний стан, випромінюючи
фотон з частотою
![]() .
.
За
малого тиску ртутної пари і відповідних
значеннях напруги електрони за час до
зіткнення можуть набувати значення
енергії ,
![]() і т.д., передаючи ці енергії атомам ртуті,
переводячи їх у збуджені стани. Перехід
атомів із збуджених станів у менш
збуджені або в основний супроводжується
світінням лампи і слабким потріскуванням.
і т.д., передаючи ці енергії атомам ртуті,
переводячи їх у збуджені стани. Перехід
атомів із збуджених станів у менш
збуджені або в основний супроводжується
світінням лампи і слабким потріскуванням.
Частоту спектральних ліній в спектроскопії виражають через різницю спектральних термів:
![]() (n>m).
(n>m).
За другим постулатом Бора
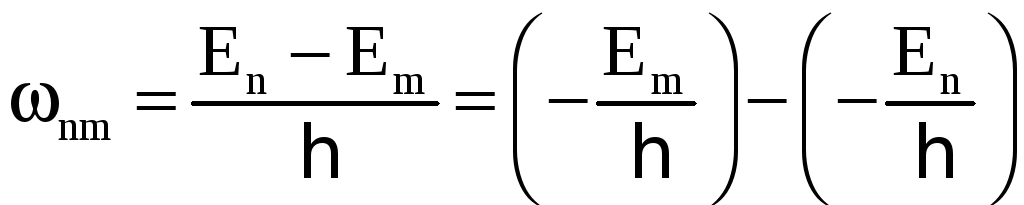 .
.
Співставлення двох останніх формул показує, що спектральний терм
. (1.13)
Таким
чином, терм тісно зв’язаній з енергією
стаціонарного стану атома і відрізняється
від неї лише множником (![]() ).
).
