
- •I . Борівська теорія атома
- •1.1. Закономірність в атомних спектрах
- •1.2. Модель атома Томсона
- •1.3. Досліди по розсіянню -частинок. Ядерна модель атома
- •1.4. Постулати Бора. Дослід Франка і Герца
- •1.5. Елементарна борівська теорія водневого атома
- •II. Елементи квантової механіки
- •2.1. Гіпотеза Луї де Бройля. Корпускулярно-хвильовий дуалізм
- •2.2. Співвідношення невизначеностей Гейзенберга
- •2.3. Рівняння Шредінгера
- •2.4. Фізичний зміст псі-функції
- •2.5. Квантування енергії
- •2.6. Рух вільної частинки
- •2.7. Частинка в нескінченно глибокій потенціальній ямі
- •2.8. Гармонічний осцилятор
- •2.9. Проходження частинки крізь потенціальний бар’єр
- •2.10. Квантування моменту імпульсу
- •III. Квантова теорія атомів і молекул
- •3.1. Квантова теорія атома водню
- •3.2. Багатоелектронні атоми
- •3.2.1. Спектри лужних металів
- •3.2.2. Нормальний ефект Зеємана
- •3.2.3 Мультиплетність спектрів і спін електрона
- •3.2.4 Механічний та магнітний моменти багатоелектонного атома
- •3.2.5. Розподіл електронів в атомі за станами. Періодична система елементів д.І. Менделєєва
- •3.2.6. Рентгенівські спектри
- •3.2.7. Енергія молекули
- •3.2.8. Молекулярні спектри
- •3. 2. 9 Комбінаційне розсіювання світла
- •3. 2.10. Вимушене випромінювання. Лазери
- •I. Борівська теорія атома………………………………………………………..…3
1.2. Модель атома Томсона
Згідно з класичною теорією атом міг би випромінювати монохроматичну хвилю (тобто спектральну лінію) в тому випадку, якби електрон в атомі виконував гармонічні коливання відносно положення рівноваги.
Н а
підставі досліджень атомних спектрів
водню і положень класичної теорії Томсон
в 1903р. запропонував модель атома водню,
у відповідності з якою атом водню
представляє собою рівномірно заповнену
позитивно заряджену кульку, всередині
якої електрон виконує коливальний рух
відносно центра кульки.
а
підставі досліджень атомних спектрів
водню і положень класичної теорії Томсон
в 1903р. запропонував модель атома водню,
у відповідності з якою атом водню
представляє собою рівномірно заповнену
позитивно заряджену кульку, всередині
якої електрон виконує коливальний рух
відносно центра кульки.
Позитивний заряд атома дорівнює заряду електрона і в цілому атом є електронейтральним. Томсон розрахував розміри атома, виходячи з таких положень:
н
Рис.
1.1
![]() .
За
природою
ця сила
електростатична:
.
За
природою
ця сила
електростатична:
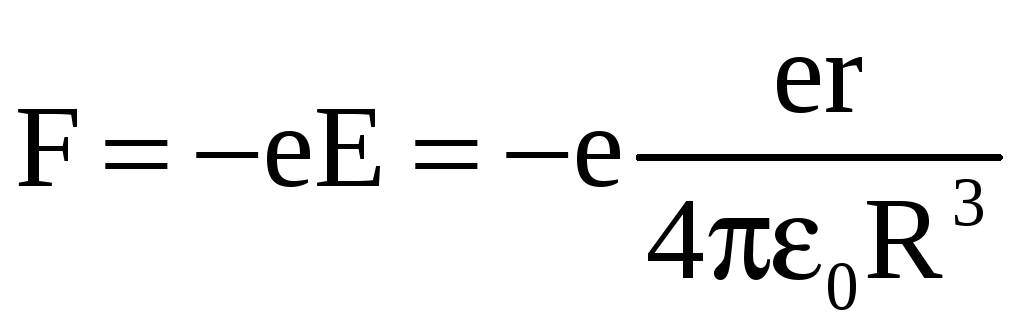 .
.
Співставивши ці формули для сил, отримуємо
 .
(1.9)
.
(1.9)
Довжині
хвилі ![]() Å
(видима область спектра) відповідає
частота
Å
(видима область спектра) відповідає
частота ![]() .
Отже
.
Отже
 .
.
Отриманий результат по порядку величини співпадає з газокінетичними розмірами атомів, що можна було б розглядати як підтвердження моделі Томсона. Але в подальшому вияснилась неспроможність цієї моделі в пояснені фізико-хімічних властивостей водню і інших елементів.
1.3. Досліди по розсіянню -частинок. Ядерна модель атома
На
підставі закону Кулона розподіл зарядів
у атомі можна вияснити з допомогою
«пробних» зарядів. У 1911р. (див.[7])
англійський фізик Е. Резерфорд (1871-1937)
з своїми співробітниками в якості таких
зарядів використали -частинки, потоком
яких опромінювали металеву фольгу.
Тонкий пучок -частинок, випромінюваних
радіоактивною речовиною Р
(рис. 1.2) крізь вузький отвір в захисній
камері, падав на металеву фольгу Ф.
Заряд -частинки дорівнює подвійному
заряду протона; її маса дорівнює чотирьом
масам протона, швидкість досягала
![]() .
При проходженні крізь фольгу -частинки
розсіювались від початкового напряму
на різні кути
.
При проходженні крізь фольгу -частинки
розсіювались від початкового напряму
на різні кути
![]() .
Розсіяні -частинки фіксувались з
допомогою сцінціляційного лічильника
С.Л.
.
Розсіяні -частинки фіксувались з
допомогою сцінціляційного лічильника
С.Л.
В
Рис.
1.2
![]() ).
Проаналізувавши результати дослідів,
Резерфорд дійшов висновку, що таке
сильне відхилення
).
Проаналізувавши результати дослідів,
Резерфорд дійшов висновку, що таке
сильне відхилення
![]() -частинок
можливе лише за умови, що всередині
атома існує досить сильне електричне
поле, сконцентроване у дуже малому
об’ємі – ядрі.
-частинок
можливе лише за умови, що всередині
атома існує досить сильне електричне
поле, сконцентроване у дуже малому
об’ємі – ядрі.
Скориставшись законом збереження імпульсу системи -частинка – ядро атома, Резерфорд запропонував кількісну теорію розсіяння -частинок атомами, з якою можна ознайомитись за посібниками [2], [6], [7] та ін.
Прийнявши,
що кінетична енергія ![]() -частинки
перетворюється на її потенціальну
енергію взаємодії при зіткненні з ядром:
-частинки
перетворюється на її потенціальну
енергію взаємодії при зіткненні з ядром:
![]() ,
(1.10)
,
(1.10)
де
k – коефіцієнт в законі Кулона, - заряд
ядра. Із формули (1.10) знаходимо,
мінімальна відстань між центрами ядра
і
![]() -частинки:
-частинки:
![]() =
=![]() ,
,
що наближається до стандартних даних.
Таким чином, на основі експериментальних дослідів Резерфорд запропонував ядерну модель будови атома: в центрі атома міститься позитивно заряджене ядро розміром близько м, навколо ядра по замкнених орбітах в об’ємі сфери м обертаються електрони, причому число їх дорівнює порядковому номеру елемента в періодичній таблиці елементів Д.І. Менделєєва.
Модель
атома Резерфорда добре пояснювала
розсіювання ![]() -частинок
атомами різних елементів, проте з погляду
законів класичної фізики вона була
неспроможна пояснити закономірності
в лінійчатих спектрах атомів і навіть
сам факт випромінювання атомом
монохроматичного світла; не могла вона
також пояснити характерної стійкості
атома.
-частинок
атомами різних елементів, проте з погляду
законів класичної фізики вона була
неспроможна пояснити закономірності
в лінійчатих спектрах атомів і навіть
сам факт випромінювання атомом
монохроматичного світла; не могла вона
також пояснити характерної стійкості
атома.
Річ у тім, що за законами класичної електродинаміки обертання електрона навколо ядра внаслідок доцентрового прискорення має супроводжуватись випромінюванням електромагнітних хвиль, у результаті чого енергія електрона має зменшуватись, а тому мусить зменшуватись і відстань електрона до ядра(відповідно частота його обертання має зростати). Отже, випромінювання електрона давало б суцільний спектр, і він дуже швидко впав би на ядро. Обидва ці наслідки класичної теорії не відповідають дійсності.
