
Щелочные и щелочноземельные металлы.
Опыт 1. Взаимодействие натрия с водой.
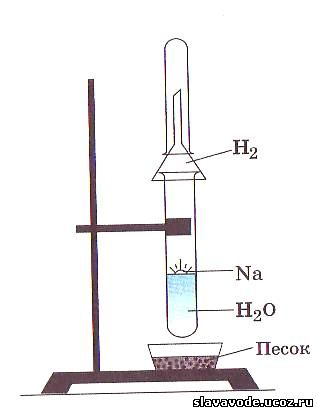
Маленький кусочек металлического натрия осторожно извлеките из керосина и опустите в пробирку с водой (см. рис). Соберите в пробирку выделяющийся газ и проверьте его тлеющей лучиной. К полученному раствору прибавьте 1 каплю фенолфталеина.
Визуальные наблюдения _______________________________________________
____________________________________________________________________
Уравнение реакций ___________________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
Опыт 2. Окрашивание пламени солями щелочных металлов.
В пламени спиртовки несколько раз прокаливают нихромовую проволоку. Смачивают ее в растворе хлорида калия и вносят в пламя спиртовки. Наблюдают фиолетовое окрашивание.
Проволоку промывают в соляной кислоте, хорошо прокаливают, затем смачивают в растворе соли хлорида лития и вносят в пламя. Появляется малиновое окрашивание. После обработки в соляной кислоте и прокаливания проволоку, смоченную в растворе хлорида натрия, вносят в пламя. Наблюдают желтое окрашивание.
Визуальные наблюдения _______________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
Опыт 3. Гидролиз солей щелочных металлов.
В пробирки внести растворы солей щелочных металлов. Проверьте рН растворов с помощью индикатора.
Визуальные наблюдения _______________________________________________
____________________________________________________________________
Уравнение реакций ___________________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
Опыт 4. Получение оксида и гидроксида кальция.
Пользуясь щипцами, прокалите небольшой кусочек мела на пламени спиртовки в течение нескольких минут. После этого опустите образовавшийся твердый продукт разложения в пробирку с дистиллированной водой. К полученному раствору прибавьте 1 каплю фенолфталеина.
Визуальные наблюдения _______________________________________________
____________________________________________________________________
____________________________________________________________________
Уравнение реакций ___________________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
________________________________________________________________________________________________________________________________________
Опыт 5. Получение и свойства гидроксида магния.
В пробирку с раствором соли магния прибавьте по каплям раствор щелочи до образования осадка. Полученный осадок разделите на три части и поместите в пробирки. В первую прибавьте по каплям концентрированный раствор щелочи, во вторую — концентрированную соляную кислоту, в третью — насыщенный раствор хлорида аммония NH4C1.
Визуальные наблюдения _______________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
Уравнение реакций ___________________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
Опыт 6. Окрашивание пламени солями щелочноземельных металлов.
Платиновую проволочку опустите в насыщенный раствор соли кальция. Извлеченную проволочку внесите в пламя горелки. Повторите опыт с насыщенными растворами солей магния, стронция, бария.
Визуальные наблюдения _______________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________________________________________________________________________________________________________________________________________________
Опыт 7. Гидролиз солей щелочноземельных металлов.
В пробирки внести растворы солей щелочноземельных металлов. Проверьте рН растворов с помощью индикатора.
Визуальные наблюдения _______________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
Уравнение реакций ___________________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
Контрольные вопросы к лабораторной работе
«ЩЕЛОЧНЫЕ И ЩЕЛОЧНОЗЕМЕЛЬНЫЕ МЕТАЛЛЫ».
1. Щелочные металлы. Электронная структура атомов.
2. Какие, окислительные или восстановительные свойства проявляют щелочные металлы и почему?
3. Щелочные металлы. Распространение в природе.
4. Гидроксиды щелочных металлов. Физические и химические свойства. Применение в технике.
5. Элементы IIА группы. Электронная структура атомов. Как изменяются свойства металлов с увеличением порядкового номера?
6. Щелочноземельные металлы. Распространение в природе.
7. Жесткость воды. Способы устранения карбонатной и некарбонатной жесткости воды.
8. Сколько граммов гидрокарбоната кальция содержится в 2 м3 воды, жесткость которой равна 5 мэкв/л ?
9. Определите временную жесткость воды, если на титрование 0,05 л воды израсходовано 0,003 л 0,1н раствора соляной кислоты.
10. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
MgO → MgSO4 → Mg(OH)2 → MgOHCl → MgCl2 → MgCO3 → MgO
11. Допишите уравнения реакций:
K + H2O → ; Na2O + H2O → ; K + Cl2 → ;
Mg + H2SO4 (конц.) → ; Mg + H2SO4 (разб.) → ;
Mg + HNO3 (конц.) → ; Mg + HNO3 (разб.) →
12. Вычислить, какой объем воды (ρ = 1 г/см3) необходим для гашения 5,6 т извести активностью 90%?
13. Сколько углекислого газа (н.у.) выделится при термическом разложении 150 тонн известняка с содержанием карбоната кальция 98%?
14. Какой объем 1М раствора KOH может быть приготовлен из 2 л 35% раствора (ρ = 1,34 г/см3)?
Для заметок_______________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
ЛАБОРАТОРНАЯ РАБОТА №7. МАРГАНЕЦ. ЖЕЛЕЗО
ОПЫТ 1 . Получение и свойства гидроксида марганца (II)
В пробирку с раствором соли марганца добавьте раствор гидроксида натрия. Полученный осадок разделите на две части и поместите в пробирки. В первую прибавьте раствор гидроксида натрия, во вторую — раствор соляной кислоты.
Визуальные наблюдения _______________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
Уравнение реакций ___________________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
ОПЫТ 2. Окислительные свойства перманганата калия
а) Окисление перманганатом калия соли марганца.
В пробирку с раствором перманганата калия прибавьте раствор соли марганца (II).
Визуальные наблюдения _______________________________________________
________________________________________________________________________________________________________________________________________
Уравнение реакций ___________________________________________________
____________________________________________________________________
____________________________________________________________________________________________________________________________________________________________________________________________________________
б) Окисление перманганатом калия пероксида водорода.
В пробирку внесите раствор перманганата калия, подкислите 2-3 каплями разбавленной серной кислотой и добавьте раствор пероксида водорода. Определите выделяющийся газ тлеющей лучиной.
Визуальные наблюдения _______________________________________________
____________________________________________________________________
____________________________________________________________________
Уравнение реакций ___________________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
в) Восстановление перманганата калия сульфитом натрия(или нитритом натрия) при различных значениях рН среды.
В три пробирки внесите по 1 см3 раствора перманганата калия. В первую пробирку добавьте раствор разбавленной серной кислоты, во вторую — воду, в третью — раствор щелочи. Затем в каждую пробирку добавьте раствор восстановителя (Na2S03 или NaNO2).
Визуальные наблюдения _______________________________________________
____________________________________________________________________
____________________________________________________________________
Уравнение реакций ___________________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
Опыт 2. Качественные реакция на ионы железа.
а) Качественная реакция на ион железа (II).
В пробирку налейте раствор соли железа (II), подкислите 2-3 каплями разбавленной серной кислотой и добавьте раствор гексацианоферрата (III) калия до выпадения темно-синего осадка турнбуленовой сини. Полученный осадок разделите на две части и поместите в пробирки. В первую прибавьте раствор гидроксида натрия, во вторую — раствор соляной кислоты.
Визуальные наблюдения _______________________________________________
____________________________________________________________________
____________________________________________________________________
Уравнение реакций ___________________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
б) Качественная реакция на ион железа (III).
В пробирку налейте раствор соли железа (III), прибавьте столько же разбавленного раствора соляной кислоты и добавьте раствор гексацианоферрата (II) калия до выпадения темно-синего осадка берлинской лазури. Полученный осадок разделите на две части и поместите в пробирки. В первую прибавьте раствор гидроксида натрия, во вторую — избыток гексацианоферрата (II).
Визуальные наблюдения _______________________________________________
____________________________________________________________________
____________________________________________________________________
Уравнение реакций ___________________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
Опыт 3. Восстановительные свойства соединений железа (П)
а) Восстановление перманганата калия.
В пробирку налейте раствор перманганата калия, подкислите 2-3 каплями разбавленной серной кислотой и добавьте раствор соли Мора. В полученном растворе определите наличие ионов Fe3+ качественной реакцией с роданидом калия (или аммония).
Визуальные наблюдения _______________________________________________
____________________________________________________________________
____________________________________________________________________
Уравнение реакций ___________________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
б) Восстановление дихромата калия.
В пробирку налейте раствор дихромата калия, подкислите 2-3 каплями разбавленной серной кислотой и добавьте раствор соли Мора. В полученном растворе определите наличие ионов Fe3+ качественной реакцией с роданидом калия (или аммония).
Визуальные наблюдения _______________________________________________
____________________________________________________________________
____________________________________________________________________
Уравнение реакций ___________________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
Опыт 4. Окислительные свойства соединений железа (Ш).
а) Окисление иодида калия.
В пробирку с раствором соли железа (Ш) добавьте раствор иодида калия.
Визуальные наблюдения _______________________________________________
____________________________________________________________________
____________________________________________________________________
Уравнение реакций ___________________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
б) Окисление цинка.
В пробирку с раствором соли железа (Ш) внесите кусочек цинка.
Визуальные наблюдения _______________________________________________
____________________________________________________________________
____________________________________________________________________
Уравнение реакций ___________________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
Опыт 5. Получение сульфидов железа.
В одну пробирку налейте раствор соли железа (Ш), в другую — такой же объем раствора соли Мора. В пробирки добавьте раствор сульфида аммония до выпадения осадка.
Визуальные наблюдения _______________________________________________
____________________________________________________________________
Уравнение реакций ___________________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
Опыт 6. Гидролиз солей железа.
а) Гидролиз сульфата железа (II).
В пробирку внесите соль Мора, добавьте дистиллированную воду и взболтайте. Установите реакцию среды в полученном растворе.
Визуальные наблюдения _______________________________________________
____________________________________________________________________
____________________________________________________________________
Уравнение реакций ___________________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
б) Гидролиз хлорида железа (III).
В пробирку внесите хлорид железа (Ш), добавьте дистиллированную воду и взболтайте. Установите реакцию среды в полученном растворе.
Визуальные наблюдения _______________________________________________
____________________________________________________________________
____________________________________________________________________
Уравнение реакций ___________________________________________________
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
Контрольные вопросы к лабораторной работе «МАРГАНЕЦ. ЖЕЛЕЗО».
1. Марганец. Электронная структура атома. Степени окисления.
2. Марганец. Распространение в природе. Основные минералы.
3. Оксиды марганца. Структура, химические свойства.
4. Окислительные свойства перманганата калия в зависимости от рН среды.
5. Железо. Электронная структура атома. Степени окисления.
6. Железо. Распространение в природе. Железные руды.
7. Производство чугуна и стали. Сплавы железа.
8. Оксиды и гидроксиды железа, химические свойства.
9. Укажите качественные реакции на присутствие в растворе солей двухвалентного и трехвалентного железа.
10. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Fe → FeCl2 → Fe(OH)2 → Fe(OH)3 → Fe2 (SO4)3 → Fe2O3
11. Методом электронного баланса расставьте коэффициенты и закончите составление уравнений окислительно-восстановительных реакций:
KMnO4 + K2SO3 + H2SO4 → MnSO4 + K2SO4 + …..
KMnO4 + K2SO3 + H2O → MnO2 + K2SO4 + …..
KMnO4 + K2SO3 + KOH → K2MnO4 + K2SO4 + …..
12. Какая масса гидроксида железа (II) вступает в реакцию с гидроксидом аммония в нейтральной среде, если объем выделившегося аммиака (н.у.) равен 1,12 л?
13. Какой объем кислорода (н.у.) выделится при термическом разложении 10 г перманганата калия?
14. Какую массу кристаллогидрата Fe2 (SO4)3 • 9H2O необходимо взять для приготовления 200 г 15% раствора сульфата железа (III)?
Для заметок_______________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА:
1.Глинка Н.Л Общая химия: Учебное пособие для вузов / Н.Л.Глинка; Под ред. В.А. Рабиновича. - 22-е изд., испр. - Л.: Химия, 1982. – 720 с.
2. Карапетьянц М.Х. Общая и неорганическая химия / М.Х.Карапепетьянц, С.И.Дракин. – М.:Химия, 1993. – 592 с.
3. Ахметов.Н.С. Общая и неорганическая химия / Н.С. Ахметов. – М.: Высшая школа, 2001. – 743 с.
4. Балятинская Л.Н. Методические указания к выполнению лабораторного практикума по дисциплине «Неорганическая химия». Ч.2. Химия элементов и их соединений / Л.Н. Балятинская, И.П. Лукина, В.И. Дейнека и др. – Белгород: Изд-во БелГУ, 2007. – 108 с.
5. Клименко В.Г. Химия элементов: Задание по самоподготовке для студентов… / В.Г. Клименко, А.Н. Володченко. – Белгород, Изд-во БелГТАСМ, 1999. – 87 с.
6. Бабич Л.В. Практикум по неорганической химии: Учебное пособие для студентов пед. ин-тов / Л.В. Бабич, С.А.Балезин, Ф.Б. Гликина и др. - 4-е изд. перераб. - М.: Просвещение, 1991. – 320 с.
