
- •Глава1. История развития биоорганической химии …………………………………
- •Глава 2. Лекции по биоорганической химии …………………………………………
- •Глава 1
- •1.. Характеристика химических связей в биоорганических соединениях
- •2. Сопряженные системы
- •2.1. Общие понятия о строении сопряженных систем
- •Ациклические сопряженные системы. Особенности электронного строения
- •2 . 3 . Циклические сопряженные системы. Ароматичность
- •2. 3. 2. Медико-биологическое значение карбоциклических ароматических
- •2. 3. 3. Гетероциклические ароматические соединения
- •Медико- биологическое значение гетероциклических ароматических соединений
- •2.1. Взаимное влияние атомов в молекулах биоорганических соединений.
- •2.2. Кислотно-основные свойства органических соединений
- •Электроотрицательности атома, несущего неподеленную пару электронов.
- •Влияние природы заместителя
- •2.3. Медико- биологическое значение изучения темы « Кислотно-основные
- •3.1. Виды изомерии
- •3.2. Структурная изомерия.
- •3.2.1. Изомерия скелета
- •3.3. Динамическая изомерия.
- •3. 3.1. Кето-енольная таутомерия.
- •3.3.2. Лактим-лактамная таутомерия
- •3.4 Пространственная изомерия
- •3.4.1 Геометрическая( цис, транс) изомерия
- •Оптическая ( зеркальная) изомерия
- •Пространственное строение шестичленных циклов
- •3.4.4. Медико-биологическое значение стереоизомерии
- •4.1 Классификация реакций в биоорганической химии
- •4.1.1 Типы разрыва химических связей
- •4.1.2. Гомолитический тип разрыва связей.
- •4.1.3. Гетеролитический тип разрыва связей
- •Механизмы биоорганических реакций
- •4.2.1. Реакции электрофильного присоединения в ряду алкенов(а е)
- •4.2.2. Реакции нуклеофильного присоединения
- •Образование полуацеталей и ацеталей
- •Присоединение натрия гидросульфита
- •7. Реакции у α- углеродного атома в карбонильных соединениях
- •8. Альдольная конденсация
- •1. Реакция нитрования
- •2. Реация сульфирования
- •3. Реакция галогенирования
- •4. Реакция алкилирования
- •4.2.4. Реакции нуклеофильного замещения ( s n )
- •Окислительно-восстановительные реакции ( оксидо-редуктазные)
- •Лекция 5 карбоновые кислоты и их гетерофункциональные
- •5.1. Классификация карбоновых кислот
- •5.2. Строение карбоксильной группы
- •5.2.1. Значение величин рКа некоторых карбоновых кислот :
- •5.3. Химические свойства карбоновых кислот
- •Этилацетат
- •5.4. Характеристика отдельных представителей монокарбоновых кислот ,
- •Масляная кислота ( н- бутановая кислота)
- •5.5. Непредельные монокарбоновые кислоты
- •5.6. Дикарбоновые кислоты
- •5.7. Непредельные ди- и трикарбоновые кислоты
- •5.8. Гидроксикислоты
- •5.8.3. Дигидроксидикарбоновые кислоты
- •5.9. Oксокарбоновые кислоты( альдегидо -, кетокарбоновые кислоты)
- •5.10 Приложение : Происхождение названий карбоновых кислот Сn н2n о2
- •6.1. Определение « липиды»
- •Классификация липидов
- •6.3. Основные представители липидов
- •6.3.1. Природные высшие карбоновые кислоты
- •Образование соли
- •3. Тиоэфиры
- •4. Дегидрирование насыщенной кислоты в активной форме с участием фермента.
- •6.3.2. Триацилглицерины( триглицериды)
- •6.3.3. Фосфатиды ( фосфолипиды ) и фосфатидовая кислота
- •Холестерин( холестерол) и его производные
- •6. 4. Принципы создания липотропных лекарственных препаратов
- •6.5 . Строение и химический состав мембран клеток
- •7.1. Номенклатура, особенности пространственного и структурного строения природных аминокислот
- •7. 2 Классификация природных аминокислот
- •7. 3 Физические свойства природных аминокислот
- •7.4 Поведение аминокислот в водных растворах: образование цвиттер-ионов, изменение заряда и электрофоретической подвижности в зависимости от рН-среды. Изоэлектрическая точка
- •7.5. Качественная реакция обнаружения аминокислот
- •7. 6 . Химические свойства аминокислот
- •7 .6. 1 Химические свойства аминокислот in vitro
- •7.6.2. Химические свойства аминокислот in vivo
- •7.7. Строение витамина в6 и механизм реакции с его участием
- •7.8. Реакция поликонденсации, образование полипептидов
- •7. 9. Медико - биологическое значение аминокислот
- •7. 10. Применение аминокислот и их производных в качестве
- •Незаменимые аминокислоты обозначены звездочкой*
- •8.1. Определения « пептид» «белок»
- •8.2. Классификация белков
- •8.3. Строение пептидов и белков.
- •8.3.1. Первичная структура белка
- •8.3.2. Вторичная структура белка
- •8.3.3. Третичная и четвертичная структура белка
- •8.4. Физико-химические свойства белка
- •8.4.1. Амфотерность - кислотно- основные свойства белков.
- •8.4.2. Денатурация белка
- •8.5. Качественные реакции обнаружения белков в биологических объектах.
- •8. 6. Приложение. История развития химии белков
- •9. 1. Классификация углеводов
- •9.2. Моносахариды
- •9.3. Изомерия моносахаридов. Стереоизомерия. L- и д- ряды. Диастереомеры, энантиомеры, эпимеры. Значение отдельных представителей
- •9.4 Химические свойства моносахаридов
- •9.4. 3. Фосфорные эфиры
- •9.4.3 Образование гликозидов
- •9.4.4. Реакции восстановления
- •9.4.5 Реакции окисления моносахаридов
- •9.5. Биологическое значение моносахаридов и их производных.
- •10.1. Олигосахариды. Дисахариды
- •10.1.1. Нередуцирующие дисахариды
- •10.1.2 Редуцирующие дисахариды.
- •10.2. Полисахариды
- •10.2.1. Гомополисахариды
- •11.1. Классификация нуклеиновых кислот, отличия в строении и составе как следствие различных биологических функций
- •11.2. Азотистые основания нуклеиновых кислот
- •Азотистые т основания- производные пиримидина
- •11.2.2. Азотистые основания- производные пурина( аденин, гуанин)
- •11.3. Нуклеозиды
- •11.4. Нуклеотиды
- •11.5. Строение нуклеиновых кислот
- •11.6. Метаболизм пуриновых соединений в клетке
- •11.7. Биологически важные соединения- мононуклеотиды, динуклеотиды- участники важнейших биохимических процессов
- •11.8 Приложение . Справочные материалы к теме лекции
- •1953 – Дж. Уотсон и ф. Крик - модель двухцепочечной структуры днк.
- •12.1 Современная концепция создания биоорганических соединений –
- •12.1.1. Особые химические требования к лекарственному веществу
- •12.1.3. . Пути поиска и создания лекарственных препаратов
- •12.1.4 Классификация лекарственных веществ
- •12.2 Синтез, химические и физические свойства лекарственных соединений
- •12.2.1. Производные 4-аминобензойной кислоты
- •12.2.2. Производные 4-аминобензолсульфокислоты
- •Hso3Cl сульфохлорирование h2nr’ амин
- •Ацетиланилин
- •12. 2. 3. Лекарственные средства, производные салициловой кислоты
- •12.2.4. Лекарственные средства, производные 4 –аминофенола
- •12.2.5 Лекарственные средства на основе пиридинкарбоновых кислот
- •12. 2. 6. Производные пиримидина
- •12. 2 .7. Производные пурина- кофеин, теофиллин, теобромин
- •13.1. Номенклатура алкалоидов
- •13.2. Классификация алкалоидов
- •13. 3. Функции алкалоидов
- •13.4. Содержание в растениях
- •13.5. Качественные реакции обнаружения алкалоидов
- •13.6. Фармакологическая активность- общий взгляд
- •13.7. Отдельные представители
- •13. 7.1. Алкалоиды группы фенилэтиламина
- •7.2 Производные пяти – и шестичленных гетероциклических соединений
- •137.3. Группа тропана
- •13.8. Витамины
- •Действие в организме
- •Стадии зрительного процесса на сетчатке глаза
- •14.1. Полимеры-определение. Виды полимеров
- •14. 2. Классификация вмс
- •14.3. Реакции полимеризации
- •14.3.1. Номенклатура полимеров.
- •14.3.2 . Общая характеристика мономеров.
- •14.3.3. Механизмы реакции полимеризации
- •14.4. Радикальная полимеризация
- •14.5. Ионная полимеризация
- •14.5.1. Катионная полимеризация
- •14.5.2. Анионная полимеризация
- •14.6. Координационная полимеризация
- •14.7.1. Блочная полимеризация
- •14.7.2. Эмульсионная полимеризация
- •14.7.3. Полимеризация в растворе
- •14.8. Конфигурация полимеров
- •14. 10. Физическое состояние полимеров
- •14.10.1. Аморфные полимеры
- •14 10.2. Кристаллические полимеры
- •14.11. Натуральный каучук
- •14.12 . Конденсационные полимеры
- •14. 13 Основные представители вмс
- •2. Структурные формулы биоорганических соединений
- •Сопряженные соединения
- •Карбоновые кислоты (указаны тривиальные названия)
- •Незаменимые аминокислоты обозначены звездочкой -*
- •Углеводы и их производные
- •Азотистые основания и их производные
- •1. Теоретические положения строения и свойств биоорганических
- •2. Важнейшие биополимеры организма
- •3. Липиды и низкомолекулярные регуляторы метаболизма.Важнейшие группы лекарственных средств
- •Курс лекций по биоорганической химии
- •060103 – Педиатрия
- •060104 –Медико-профилактическое дело
- •060105 - Стоматология
5.8.3. Дигидроксидикарбоновые кислоты
Дигидроксибутандиовые кислоты ( винная, виноградная) – известны три изомера :.
D- винная, L- винная и мезовинная кислоты, все твердые кристаллические вещества, растворимые воде.
СООН СООН СООН
| | |
Н- C - ОН НО- C -Н Н- C -ОН
| | |
НО- С - Н Н - С - ОН Н - С - ОН
| | |
CООН СООН СООН
D - винная L- винная мезовинная
D - винная и L- винная кислоты - энантиомеры, их называют виноградной кислотой; две пары : D - винная и мезовинная , L- винная и мезовинная – диастереомеры. Мезовинная кислота- оптически неактивна ввиду внутренней симметрии молекулы.
D - винная кислота в виде кислой соли( винного камня) выделяется в осадок из красного виноградного вина. Изучая винные кислоты, в 1830г. И. Берцелиус ввел понятие изомерии, а в 1848 г. Л. Пастер разделил их на оптические антиподы. Соли винной кислоты называются тартраты.
В медицине используется лекарство антимонила –натрия тартрат ( натрий винносурьмянокислый) для лечения цистозоматозов. Обладает сильным рвотным действием, известен под названием « рвотный» камень.
Его состав (SbО) ООС-СНОН-СНОН-СООК
Двойная соль винной кислоты калия - натрия тартрат КООС-СН(ОН)-СН(ОН)СООNа в аналитической химии используется для получения реактива Фелинга( проведение качественной реакции для обнаружения глюкозы и ряда других углеводов). В 17 в. аптекарь Сенье предложил использовать это соединение как слабительное средство (отсюда происхождение названия сегнетова соль). В 20 веке обнаружили особые физические свойства данной соли, которая положила начало исследованию веществ-сегнетоэлектриков, обладающих пьезоэффектом, которые применяются в радиотехнике, для создания генераторов переменной частоты, в том числе и в производстве медицинской аппаратуры. Сегнетова соль является оптически активным соединением, так как исчезает симметричное строение из-за присутствия двух разных катионов: натрия и калия.
5.8.4. Гидрокситрикарбоновая кислота - лимонная, изолимонная кислоты-
производные трикарбалиловой кислоты
CООН СООН
| |
НООС- СН2 – С -СН2- СООН НООС- СН-СН-СН2-СООН
| |
ОН ОН
лимонная кислота изолимонная кислота
Лимонная кислота( цитрат) твердое кристаллическое вещество, растворима в воде.
Принадлежит к наиболее распространенным кислотам растений: в большом количестве находится в соке лимонов( 6-8%), в смородине, бруснике, в свекольном соке, хвое, вине. В животных и человеческих клетках образуется в митохондриях, где в матриксе с ее участием проходит комплекс реакций, получивших название « цикл Кребса, или цикл трикарбоновых кислот).
В реакциях in vivo она образуется в реакции соединения( конденсации) АцетилКоА и щавелевоуксусной кислоты.


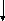 СООН
СООН
|
НООС – СН 2– С -СООН + Н - СН2 - СОSКоА ——> НООС-СН2-С-СН2 -СООН
 | |
-НSКоА
|
| |
-НSКоА
|
 О
ОН
О
ОН
Образует кислые и средние соли, связывает ионы кальция, ее используют в качестве антикоагулянта , добавляя к препаратам крови для предотвращения свертываемости, поскольку ионы кальция входят в состав факторов свертывающей системы крови.
При дегидратации лимонная кислота превращается в аконитовую( в реакциях цикла Кребса в цис-аконитовую);. Гидратация цис - аконитовой сопровождается образованием изомера- изолимонной кислоты ( направление реакции соответствует правилам реакции А Е - электрофильного присоединения )
- Н2 О СООН + Н2 О СООН
Лимонная кислота ——> | ——> |
СН2 СН2
| |
С- СООН С - СООН
| | |
С-Н ОН – С - Н
| |
СООН СООН
цис- аконитовая кислота изолимонная кислота
Лимонная и изолимонная кислоты отличаются положением гидроксигруппы: цитрат – третичный спирт, а изоцитрат – вторичный.
NB! Только у изолимонной кислоты гидрокси- группа может окисляться и эта реакция используется в цикле Кребса.
Лимонную кислоту используют в пищевой промышленности при изготовлении соков, напитков, кондитерских изделий, в медицине- добавка в производстве ряда лекарственных препаратов ( цитрамон – против головной боли), стерильный
4-5%раствор цитрата натрия используют для консервирования крови.
