
- •Карбонові кислоти
- •Монокарбонові кислоти
- •1. Насичені монокарбонові кислоти
- •1.1. Номенклатура та ізомерія
- •1.2. Способи добування
- •1.3. Фізичні властивості
- •1.4. Хімічні властивості
- •А. Кислотні властивості
- •Б. Реакції нуклеофільного заміщення
- •В. Заміщення водню при α-вуглецевому атомі
- •Г. Окислення та відновлення
- •2. Ненасичені монокарбонові кислоти
- •2.1. Номенклатура та ізомерія
- •2.2. Способи добування
- •2.3. Фізичні властивості
- •2.4. Хімічні властивості
- •3. Ароматичні монокарбонові кислоти
- •3.1. Способи добування
- •3.2. Фізичні властивості
- •3.3. Хімічні властивості
- •1. Насичені монокарбонові кислоти.
- •Номенклатура та ізомерія.
- •Контрольні питання та вправи
Г. Окислення та відновлення
Монокарбонові кислоти, за виключенням мурашиної, досить стійкі до дії окислювачів. Мурашина кислота легко окислюється КмnО4 та іншими окислювачами з утворенням вугільної кислоти котра розкладається на оксид вуглецю (IV) та воду:
![]()
При відновленні монокарбонові кислоти утворюють залежно від умов альдегіди або первинні спирти.
2. Ненасичені монокарбонові кислоти
До ненасичених карбонових кислот відносять карбонові кислоти, які містять у вуглеводневому радикалі кратний зв’язок.
2.1. Номенклатура та ізомерія
У номенклатурі ненасичених кислот широко застосовуються тривіальні назви. За замісниковою номенклатурою ІЮПАК назви ненасичених кислот утворюють аналогічно насиченим, використовуючи суфікс -ен (-єн) для позначення подвійного зв'язку та суфікс -ин (-ін) для позначення потрійного, з указаниям положення кратного зв'язку у вуглецевому ланцюзі. Назви деяких ненасичених монокарбонових кислот наведено у табл.:

У залежності від положення кратного зв'язку відносно карбоксильної групи, розрізняють α, β-; β, γ-; γ, δ- та інші ненасичені кислоти, наприклад:

Для ненасичених монокарбонових кислот характерна структурна ізомерія, зумовлена різною структурою вуглеводневого радикала і положенням кратного зв'язку, а також геометрична ізомерія, яка пов'язана з різним розміщенням замісників відносно площини подвійного зв'язку.
2.2. Способи добування
Для добування ненасичених монокарбонових кислот можна використовувати багато які з методів синтезу насичених карбонових кислот. Як вихідні речовини застосовуються ненасичені сполуки, наприклад окислення ненасичених первинних спиртів і альдегідів за м'яких умов, гідроліз нітрилів та ін. Крім того, використовують специфічні методи добування:
Гідрокарбоксилування алкінів (реакція Реппе). У присутності карбонілів металів алкіни взаємодіють з оксидом вуглецю (II) у водному середовищі з утворенням α,β-ненасичених монокарбонових кислот:
![]()
Елімінування β-галоген- і β-гідроксикарбонових кислот. β-Галогенкарбонові кислоти при нагріванні з водою відщеплюють галогеноводень і перетворюються на α, β-ненасичені кислоти:

β-Гідроксикарбонові кислоти при нагріванні відщеплюють молекулу води та перетворюються на α, β -ненасичені кислоти:
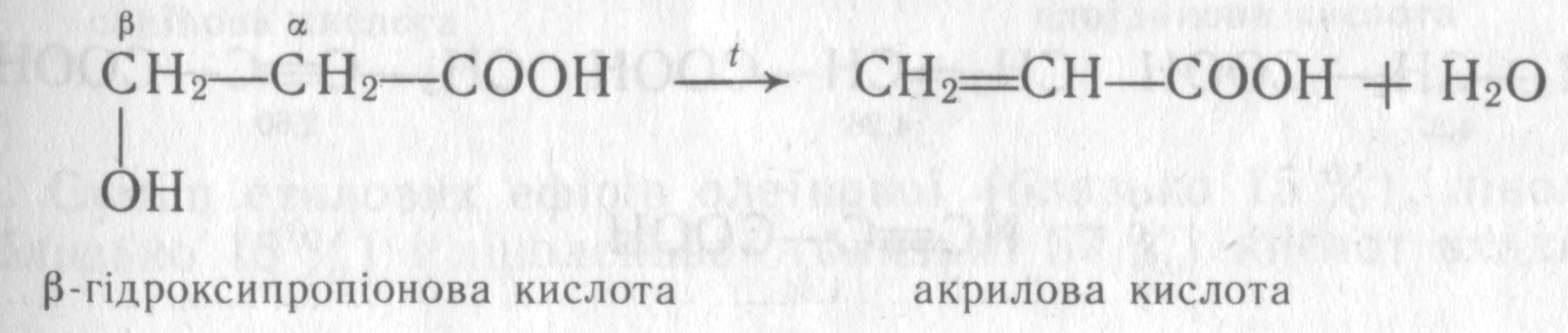
2.3. Фізичні властивості
За звичайних умов ненасичені мснокарбонові кислоти є безбарвними рідинами або кристалічними речовинами. Нижчі представники добре розчинні у воді, мають різкий подразнюючий запах. Зі збільшенням молекулярної маси кислоти розчинність у воді зменшується. Вищі ненасичені кислоті не розчинні у воді та добре розчиняються в органічних розчинниках.
2.4. Хімічні властивості
Реакційна здатність ненасичених монокарбонових кислот зумовлена наявністю у їх структурі карбоксильної групи і кратногозв'язку.
За рахунок карбоксильної групи ненасичені кислоти вступають у реакції, характерні для насичених кислот, зокрема, вони утворюють солі, галогенангідриди, ангідриди, складні ефіри, аміди. По кратному зв'язку у вуглеводневому радикалі ненасичені кислоти виявляють властивості алкенів (алкінів). Так, для них характерні реакції приєднання, окислення та полімеризації. Проте приєднання галогеноводнів до α, β-ненасичених кислот проходить проти правила Марковникова. Це пояснюється електроноакцепторним впливом карбоксильної групи за рахунок —М та —І-ефектів:

α, β- Ненасичені кислоти, особлива з потрійним зв'язком, є сильнішими кислотами у порівнянні з відповідними насиченими. Це пояснюється підвищенням стійкості аніона за рахунок делокалізації заряду по спряженій системі, Нижче наведено значення рКа У воді (при 25 °С) деяких ненасичених карбонових кислот та для порівняння рКа пропіонової кислоти:

