
- •Карбонові кислоти
- •Монокарбонові кислоти
- •1. Насичені монокарбонові кислоти
- •1.1. Номенклатура та ізомерія
- •1.2. Способи добування
- •1.3. Фізичні властивості
- •1.4. Хімічні властивості
- •А. Кислотні властивості
- •Б. Реакції нуклеофільного заміщення
- •В. Заміщення водню при α-вуглецевому атомі
- •Г. Окислення та відновлення
- •2. Ненасичені монокарбонові кислоти
- •2.1. Номенклатура та ізомерія
- •2.2. Способи добування
- •2.3. Фізичні властивості
- •2.4. Хімічні властивості
- •3. Ароматичні монокарбонові кислоти
- •3.1. Способи добування
- •3.2. Фізичні властивості
- •3.3. Хімічні властивості
- •1. Насичені монокарбонові кислоти.
- •Номенклатура та ізомерія.
- •Контрольні питання та вправи
Б. Реакції нуклеофільного заміщення
У результаті електроноакцепторних властивостей атома кисню карбонільної групи атом вуглецю карбоксильної групи набуває часткового позитивного заряду і стає електрофільним центром, котрий може бути атакований нуклеофільним реагентом:

У процесі атаки відбувається заміщення гідроксильної групи на нуклеофільну частинку.
Взаємодія зі спиртами (реакція етерифікації). Карбонові кислоти при нагріванні у присутності кислотного каталізатора реагують зі спиртами, утворюючи складні ефіри:

Реакція етерифікації є оборотною. Складний ефір, що утворюється, у кислому середовищі піддається гідролізу до вихідних кислоти та спирту. Для зміщення рівноваги в бік утворення складного ефіру або використовують надлишок одного з реагентів (звичайно спирту), або видаляють з реакційного середовища воду. Найлегше складні ефіри утворюються з первинних спиртів і нижчих карбонових кислот. Вторинні спирти та вищі кислоти реагують повільніше. Третинні спирти через просторові перешкоди насилу вступають у реакцію етерифікації. Крім того, під дією мінеральних кислот третинні спирти легко піддаються внутрішньомолекулярній дегідратації з утворенням алкенів. Каталітична дія сірчаної кислоти полягає в активації молекули карбонової кислоти. Механізм етерефікації може бути подано такою схемою:

Спочатку карбонова кислота протонується по атому кисню карбонільної групи з утворенням карбкатіона. Потім карбкатіон приєднує молекулу спирту з утворенням проміжного продукту, котрий відщеплює молекулу води та протон (повернення каталізатора), перетворюючись при цьому на складний ефір.
Взаємодія з галогенуючими реагентами (РСl3, РСl5, РВr3, SOCl2). При дії на карбонові кислоти хлоридів фосфору (III) та фосфору (V), броміду фосфору (III) або тіонілхлориду SOC12 утворюються галогенангідриди карбонових кислот:

Для добування хлорангідридів частіше використовують тіоніл-хлорид, тому що у цьому випадку утворюються газоподібні побічні продукти.
Галогенангідриди карбонових кислот - вельми реакційноздатні речовини, широко застосовувані в органічному синтезі.
Взаємодія з аміаком і амінами. При обробці карбонових кислот аміаком, первинними або вторинними амінами утворюються амонієві солі, які при нагріванні в сухому вигляді (піроліз) відщеплюють воду та перетворюються на аміди:
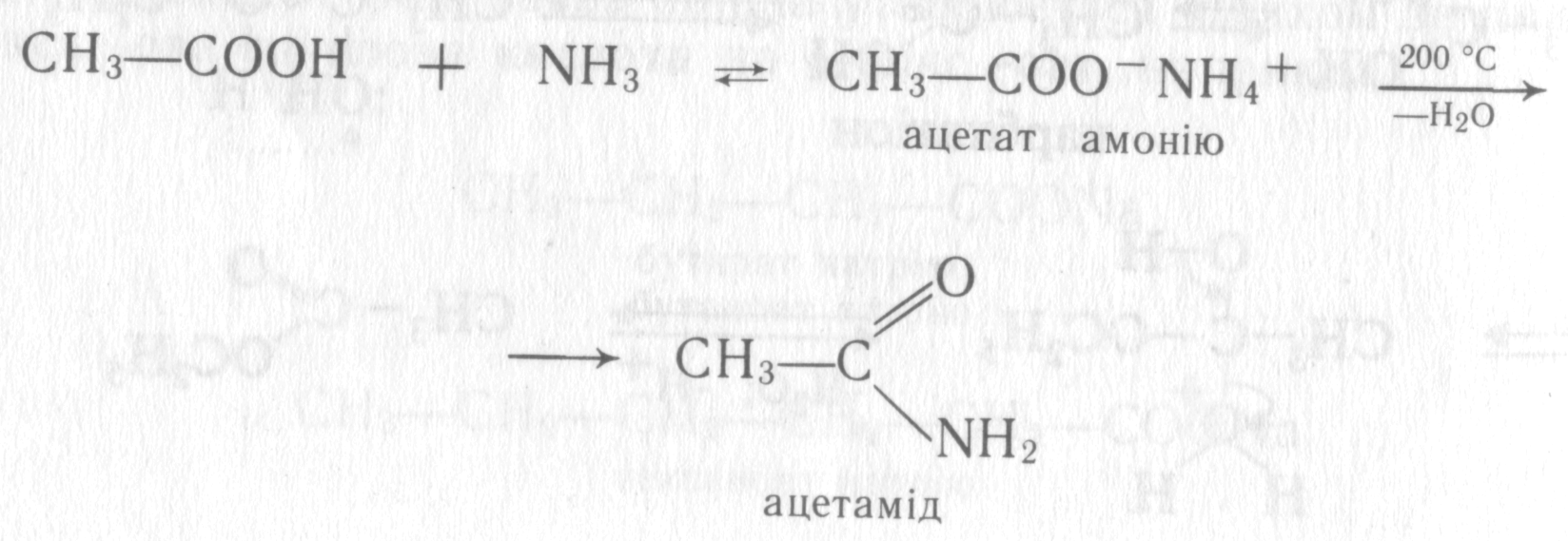
Через жорсткі умови проходження реакції цей метод утворення амідів рідко використовують з препаративною метою.
Утворення ангідридів кислот. У присутності водовіднімаючих засобів, з яких частіше застосовують оксид фосфору (V) Р2О5 або трифтороцтовий ангідрид (СF3СО)2О, карбонові кислоти при нагріванні піддаються міжмолекулярній дегідратації з утворенням ангідридів:

В. Заміщення водню при α-вуглецевому атомі
Внаслідок електроноакцепторних властивостей карбоксильної групи (—І-ефект) атоми водню при α-вуглецевому атомі набувають рухливості. Так, при обробці карбонових кислот хлором або бромом у присутності каталізатора РСl3 або РВr3 атоми водню при α-вуглецевому атомі заміщуються на на галоген:

Ця реакція відома як реакція Гелля-Фольгарда-Зелинського. При наявності в α-положенні двох атомів водню заміщенню може піддаватися один або обидва атоми водню. Реакція проходить через стадію утворення галогенангідридів кислот, які галогенуються значно легше, ніж самі кислоти:


