
Изотопы, изобары, изотоны, изомеры
Атомы,
имеющие в ядрах одинаковое число
протонов, называются изотопами.
Они в таблице Д. И. Менделеева занимают
одну клетку. Например, природный кислород
имеет три изотопа:
![]() О
(99,76 %);
О
(99,76 %);
![]() О
(0,04 %);
О
(0,04 %);
![]() О
(0,20 %).
О
(0,20 %).
Значение заряда ядра служит отличительным признаком для различных видов атомов, что позволяет привести более полное определение понятия элемента: химический элемент – это определенный вид атомов с одинаковым положительным зарядом ядра.
Большинство
химических элементов имеют атомы с
различной массой. Поэтому введено
понятие относительной атомной массы
Аr
(безразмерная величина). Относительной
атомной массой Аr
химического элемента называется
величина, равная отношению средней
массы атома естественного изотопического
состава к 1/12 массы атома углерода
![]() С.
С.
Например, Аr(Н) равна
Аr(Н)
=
 =
=
![]() = 1,0079.
= 1,0079.
Относительная атомная масса Аr – средняя величина массовых чисел его природных изотопов с учетом распространенности:
Аr(Э)
=
![]() ,
,
где Ai – относительная атомная масса изотопа; ωi – массовая доля изотопа.
Например,
определим атомную массу хлора, если
известны атомные массы и распространенности
его изотопов
![]() Cl
(75,43 %) и
Cl
(75,43 %) и
![]() Cl
(24,57 %):
Cl
(24,57 %):
Аr(Cl) = А1ω1 + А2ω2 = 350,7543 + 340,2457 = 35,491.
Как химические, так и некоторые физические свойства, зависящие от строения электронной оболочки, у изотопов почти тождественны, т. е. не отличаются по химическим свойствам и в химических реакциях ведут себя одинаково.
Изобары
– атомы с одинаковой атомной массой и
различными порядковым номером Z и числом
нейтронов N:
![]() Ar,
Ar,
![]() K,
K,
![]() Ca.
Ca.
Различают
еще изотоны
– атомы с
одинаковым числом нейтронов N, но разными
атомными массами и числом протонов Z:
![]() Xe
(54 p, 82 n),
Xe
(54 p, 82 n),
![]() Ba
(56 p, 82 n),
Ba
(56 p, 82 n),
![]() La
(57 p, 82 n).
La
(57 p, 82 n).
Также
можно отметить еще изомеры
– атомы, имеющие одинаковое число
протонов и нейтронов, но различную
энергию ядер (период полураспада):
![]() Ра
(невозбужденное состояние; 1/2
= 1,18 мин.);
Ра
(невозбужденное состояние; 1/2
= 1,18 мин.);
![]() Ра
(1/2
= 6,7 часа), где 1/2
– период полураспада (пояснение далее).
Уже известно более 200 видов изомерных
пар.
Ра
(1/2
= 6,7 часа), где 1/2
– период полураспада (пояснение далее).
Уже известно более 200 видов изомерных
пар.
Электронные спектры атомов. Теория Бора
Атом, как было уже показано, состоит из положительно заряженного ядра и вращающихся вокруг него отрицательно заряженных электронов.
В химических реакциях ядра атомов практически не изменяются. Поэтому для химии наибольший интерес представляют электроны и их взаимное расположение в атоме, так как от них зависит протекание реакций и образование тех или иных соединений.
Атомные спектры. Квантовый характер излучения. Электронные оболочки атомов. Основой для создания теории строения электронной оболочки явились опыты Э. Резерфорда по рассеянию -частиц и атомные спектры.
В 1900 г. Макс Планк, изучая распределение энергии теплового излучения, испускаемого нагретыми телами, установил, что световая энергия поглощается и излучается не непрерывно, а отдельными мельчайшими порциями – квантами. Энергия квантов Е зависит от частоты излучаемого света :
Е = h (А. Эйнштейн, 1905 г.),
где
=
![]() – частота колебаний, с = 2,998108
м/с – скорость света; h – постоянная
Планка (квант действия), коэффициент
пропорциональности между энергией и
частотой колебания, h = 6,62610–34
Джс.
– частота колебаний, с = 2,998108
м/с – скорость света; h – постоянная
Планка (квант действия), коэффициент
пропорциональности между энергией и
частотой колебания, h = 6,62610–34
Джс.
Таким образом, энергия может поглощаться или излучаться порциями h, 2 h, 3 h,..., n h, но не может - дробными частями: 1,1 h; 1,8 h и т. д. Отсюда линейчатость атомных спектров. Однако теория квантов не давала ответа, вследствие каких причин наблюдаются различные состояния электронов в атомах. Ответ на этот вопрос можно получить, только зная строение и особенности электронной оболочки атома.
Датский физик Нильс Бор в 1913 г. разработал теорию строения атома водорода, используя модель Резерфорда и квантовую теорию излучения Планка. В основу теории Бор положил два постулата.
Первый
постулат Бора.
Электрон вращается вокруг ядра по
стационарным орбитам, находясь на
которых, не излучает и не поглощает
энергию. Момент количества движения
электрона, находящегося на этих орбиталях,
имеет значения, кратные величине h/2.
При этом центростремительная сила
притяжения электрона на n-ой орбите,
равная![]() ,
компенсируется центробежной силой mVr.
Так как запас энергии электрона на
орбите равен
,
компенсируется центробежной силой mVr.
Так как запас энергии электрона на
орбите равен
![]() ,
то решая это выражение вместе с mVr =
,
то решая это выражение вместе с mVr =
![]() ,
можно получить выражение для радиуса
стационарной орбиты и скорости движения
электрона на ней.
,
можно получить выражение для радиуса
стационарной орбиты и скорости движения
электрона на ней.
rn
=
![]() =
0,5310–10n2
= 0,5310–10
м = 0,53 Å.
=
0,5310–10n2
= 0,5310–10
м = 0,53 Å.
Vn
=
![]() =2,187106
=2,187106![]() м/с,
м/с,
где h – постоянная Планка; m – масса электрона, равная 9,110–31 кг; е = 1,610–19 Кл – заряд электрона; n – номер орбиты.
Для атома водорода радиусы стационарных орбит относятся между собой как квадраты целых чисел – r1 : r2 : r3 : ... : rn = 12 : 22 : 32 : ...: n2, а скорости относятся V : V/2 : V/3 : ... : Vn/n = 1 : 2 : 3 : ...: n, т. е. на второй орбите меньше, чем на первой в два раза, на третьей – в три раза и т. д. (рис.1.3). Каждой стационарной орбите отвечает дискретное значение энергии: Е1, Е2, Е3, ... , Еn.
Второй постулат Бора. При переходе с одной орбиты на другую электрон поглощает или выделяет квант энергии, характеризующийся определенной частотой колебаний = Ед – Еб/h, или
|
|
Ед–Еб
=
После подстановки соответствующих величин получаем Ед–Еб
= 21,810–19
где Ед и Еб – энергия электрона на дальней и ближней орбитах (квантовые числа).
|
Когда электрон находится на первой орбите, он наиболее прочно связан с ядром. Это самое устойчивое состояние электрона (атома) называется нормальным (стационарным) состоянием. Все остальные состояния с большей энергией называются возбужденными. При удалении электрона с первой (ближайшей к ядру) орбиты на бесконечно большое расстояние от ядра, необходимо затратить максимальное количество энергии. Этот процесс называется ионизацией.

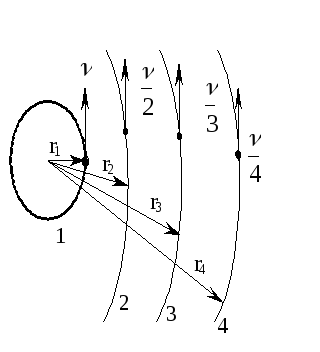 Рис.1.3.Модель
строения атома по Бору
Рис.1.3.Модель
строения атома по Бору