
- •Методы построения математических моделей.
- •Используют методы:
- •Экспериментальный;
- •Модели, связанные с технологическими процессами.
- •Кинетические модели.
- •Кинетическая модель реакции первого порядка
- •Идентификация уравнения кинетики 1-го порядка
- •Гидродинамические модели
- •Гидродинамические модели описывают движение реагентов химических аппаратов, и позволяют определить время пребывания реагента в аппарате и продолжительности химического процесса.
- •Основные типы реакторов
- •Реактор идеального смешения
- •Реактор идеального вытеснения
- •Принципы построения гидродинамической модели.
- •Реактор идеального смешения без химической реакции
- •Уравнение материального баланса по всему веществу
- •Реактор идеального смешения с химическим процессом первого порядка
- •Математические модели типового баланса теплопередачи.
- •Реактор идеального вытеснения:
Методы построения математических моделей.
Используют методы:
Экспериментальный;
аналитический;
экспериментально-аналитический.
Экспериментальный.
При построении методов управления требуются знания статики, динамики объекта в узком диапазоне вокруг рабочей точки.

Допускаются предположения:
линейность объекта;
сосредоточенность параметров;
стационарность.
Эти допущения
позволяют использовать линейные
статические модели:
![]() и
линейные дифференциальные уравнения
и определять их экспериментальными
методами на каждом объекте управления.
и
линейные дифференциальные уравнения
и определять их экспериментальными
методами на каждом объекте управления.
Достоинства: простота управления, малая трудоемкость.
Недостатки метода: нельзя использовать модели при переходе на другую рабочую точку, нельзя использовать модель на другом объекте.
Аналитический метод.
Используется для построения моделей при оптимизации процессов. При этом учитываются физико-химические процессы, характеристики сырья, режимы параметров, параметры оборудования.
При составлении моделей аналитическим путем используются уравнения материального, энергетического баланса и другие.
Достоинства: строится более общая модель, не требуется экспериментов на объекте, можно применять на других объектах управления.
Недостатки: невысокая точность, сложность процесса построения моделей, необходимость лабораторных исследований. При определении коэффициентов кинетики химических процессов, гидродинамики, тепло процессов и т. д.
По многим параметрам и режимам делаются допущения о механизме процесса. (например, при идеальном перемешивании продукта в химическом реакторе имеются ошибки в описании и точность не высока).
Для повышения точности моделей, полученных аналитическим методом, на объекте управления проводят серию экспериментов и уточняют модель. Такой метод – экспериментально-аналитический. Метод позволяет использовать и экспериментальный, и аналитический методы. Точность моделей, по полученному вектору коэффициентов В можно использовать только на объекте, где производятся эксперименты.
Смысл курсов ТОЭ, электрических машин и моделей. Считаем эти модели известными. Посмотрим построение моделей технологических процессов, включающих химические процессы, гидродинамику и т. д.
Модели, связанные с технологическими процессами.
Кинетические модели.
Кинетика – наука о скоростях химических реакций.
Скорость химической реакции – скорость изменения концентрации реагирующих веществ в единицу времени, ее зависимость от концентрации, температуры и других факторов.
По закону действия масс скорость химической реакции прямо пропорционально произведению концентрации исходных веществ, причем каждая концентрация возводится в степень, называемую порядком концентрации.
Коэффициент пропорциональности зависит от температуры (в градусах Кельвина) и называется константой скорости реакции – К.
Уравнение кинетики:
нулевого порядка:
 ,
гдеС
– концентрация компонента;
,
гдеС
– концентрация компонента;первого порядка:
 ;
;второго порядка:
 .
.
Знак (-) в правой части так как данные уравнения записаны для элемента, концентрация которого падает в процессе реакции.
Кинетическая модель реакции первого порядка

Имеется реактор с мешалкой. В изотермических условиях вещество А превращается в вещество В – с константой К.
Обозначим:
![]() – начальная концентрация веществаА.
– начальная концентрация веществаА.
![]() –
начальная концентрация вещества В.
–
начальная концентрация вещества В.
![]() – текущие значения
концентрации.
– текущие значения
концентрации.
![]() – скорость реакции.
– скорость реакции.
Запишем систему уравнений кинетики:

Вещество А переходит в вещество В, поэтому в первом уравнении знак (-), во втором знак (+).
Решим систему уравнений:
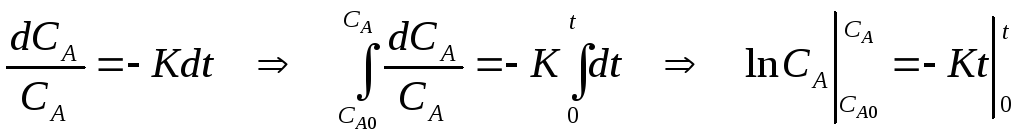
![]()

Второе уравнение:

![]()
