
- •Теплота растворения соли
- •636036, Г. Северск Томской обл.,
- •1 План коллоквиума
- •2 Теоретические основы работы и описание установки
- •3 Порядок выполнения работы
- •1 Часть – Определение постоянной калориметра:
- •2 Часть – Определение теплоты растворения исследуемой соли:
- •4 Построение графиков и расчеты
- •5 Безопасность труда
3 Порядок выполнения работы
1 Часть – Определение постоянной калориметра:
1) налить в калориметрический стакан 150 мл воды;
2) проверить настройку термометра Бекмана;
3) взвесить 2 г KCl на кусочке кальки на технических весах (точность 0,01 г);
4) ДО всыпания соли при непрерывном помешивании измерять температуру воды: взять по шкале термометра Бекмана 6–7 отсчётов через каждые 30 с. (Опыт можно начинать лишь после того, как все части калориметрической системы будут иметь одинаковую температуру. При этом температура будет либо постоянной во времени, либо равномерно изменяющейся из-за изменения температуры окружающей среды);
5) НЕ ВЫКЛЮЧАЯ секундомера, приподнять крышку калориметра, аккуратно всыпать KCl в воду так, чтобы кристаллики не попали на стенки стакана или непогруженную часть термометра. Если при этом 1–2 отсчёта температуры будут пропущены, это не скажется на точности опыта, если при построении графика для определения Δt учесть этот пропуск;
6) помешивая раствор, продолжать записывать показания термометра Бекмана через каждые 30 секунд до тех пор, пока температура после снижения не станет вновь повышаться. С этого момента повышения температуры провести еще 6‑7 измерений;
7) придерживая внутренний стакан, вылить раствор KCl в раковину. Стакан, термометр и мешалку промыть дистиллированной водой.
2 Часть – Определение теплоты растворения исследуемой соли:
Проделать опыт с исследуемой солью так же, как с KCl, согласно пунктам 1)-7).
Результаты измерений записывать в таблицу 1:
Таблица 1 – Результаты измерений
|
Опыт с KCl |
Опыт с солью ……. |
||
|
Номер измерения |
Температура |
Номер измерения |
Температура |
|
1 |
|
1 |
|
|
2 |
|
2 |
|
|
…. |
|
…. |
|
|
…. |
|
…. |
|
4 Построение графиков и расчеты
Строят два графика зависимости температуры от времени (для KCl и исследуемой соли). Для этого на миллиметровой бумаге по оси абсцисс откладывают значения времени, а по оси ординат – значения температуры. После нанесения всех экспериментальных точек получается кривая ABCD, показанная на рисунке 3 (кривая может иметь и другой вид). Время, относящееся к участку AB, в течение которого все части установки приобретают одинаковую температуру и равномерную скорость её изменения, называется «предварительным периодом». Время, относящееся к участку ВС, за которое происходит растворение соли – «главным периодом»; CD – «заключительным» (система за счёт теплообмена с окружающей средой вновь стремится приобрести комнатную температуру).
Для определения истинного значения Δt время главного периода (отрезок mn) необходимо разделить пополам и из полученной точки Е восстановить перпендикуляр до пересечения с продолжениями прямых АВ и СD. Отрезок перпендикуляра ef дает искомое значение Δt.
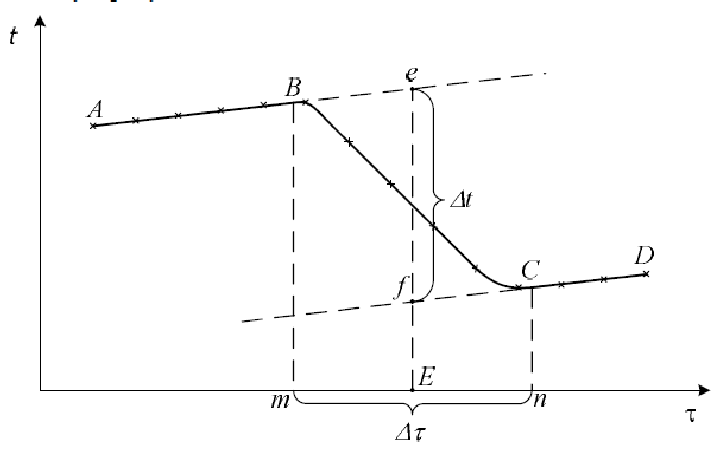
Рисунок 3 – График для определения действительного изменения температуры
в калориметре.
Рассчитав значение K по формуле (4), вычисляют удельную теплоту растворения исследуемой соли по формуле (5). Затем, узнав справочное значение теплоты растворения исследуемой соли по таблице 2, определяют абсолютную и относительную погрешности опыта.
Абсолютной погрешностью ΔА в определении какой-либо величины А является модуль разности между экспериментально полученным значением Аэксп и истинным значением Асправ:
ΔА = |Аэксп ‑ Асправ|. (6)
Абсолютная погрешность измеряется в тех же единицах, что и определяемая величина.
Относительной погрешностью δ называют отношение абсолютной погрешности к истинному значению:
![]() , % . (7)
, % . (7)
В выводах к проделанной работе следует указать значение теплового эффекта растворения соли, определенное с той или иной погрешностью.
