
- •Федеральное агентство по образованию
- •Концентрации растворов
- •Содержание
- •2. 5. Задания для самостоятельной работы……………………………………………………21
- •1. Расчет массовой доли растворенного вещества
- •1. 1. Вычисление массы растворенного вещества или растворителя по массе раствора
- •1. 2. Вычисление массы раствора определенной концентрации по заданной массе растворенного вещества или растворителя
- •1. 3. Разбавление и концентрирование растворов
- •1. 4. Расчеты, связанные со смешиванием растворов
- •1. 5. Задания для самостоятельной работы
- •2. Молярная концентрация
- •2. 1. Определение молярной концентрации вещества с(х) по массе вещества и массы вещества по заданной молярной концентрации
- •2. 2. Расчеты, связанные с разбавлением и концентрированием растворов
- •2. 3. Расчеты, связанные со смешиванием растворов различной концентрации
- •2. 4. Расчеты материального баланса химических процессов: избыток (недостаток) реагентов
- •2. 5. Задания для самостоятельной работы
- •Литература
2. 2. Расчеты, связанные с разбавлением и концентрированием растворов
При разбавлении и концентрировании растворов количество вещества (количества вещества эквивалента) остается постоянным.
Пример 6. Какой объем раствора HCl, С1(HCl) = 6 моль/л, необходимо использовать для приготовления 250 мл раствора этой кислоты с концентрацией С2(HCl) = 2,5 моль/л.
Решение:
V(HCl) =
![]()
n(HCl) = const;
n(HCl) = C2(HCl)·V2 = 2,5·0,25 = 0,625 моль
V(HCl) =
![]() = 0,104 л = 104 мл
= 0,104 л = 104 мл
Ответ: необходимо использовать 104 мл раствора.
Пример 7. До какого объема следует
упарить 3,5 л раствора серной кислоты,
С1(![]() H2SO4) = 0,04 моль/л,
чтобы получить раствор с концентрацией
кислоты 0,2 моль/л.
H2SO4) = 0,04 моль/л,
чтобы получить раствор с концентрацией
кислоты 0,2 моль/л.
Решение:
Величина n(H2SO4) определяется из данных условия:
n(H2SO4) = n(![]() H2SO4)·
H2SO4)·![]() = С1(
= С1(![]() H2SO4)·
H2SO4)·![]() ·V
= 0,04·
·V
= 0,04·![]() ·3,5
= 0,07 моль
·3,5
= 0,07 моль
Отсюда V =
![]() =
=
![]() = 0,35 л = 350 мл
= 0,35 л = 350 мл
Ответ: исходный раствор следует упарить до объема 350 мл.
2. 3. Расчеты, связанные со смешиванием растворов различной концентрации
При смешивании растворов количество вещества n(X) (количества вещества эквивалента) в полученном растворе равно сумме количества вещества (количества вещества эквивалента) в смешиваемых растворах n 1(X), n 2(X) … n n(X):
n(X) = n 1(X) + n 2(X) + n 3(X) +…+ n n(X),
При смешивании растворов объем полученного раствора не равен сумме объемов смешиваемых растворов. Это явление называют контракцией растворов. Поэтому объем полученного раствора следует рассчитывать.
При решении задач на смешивание растворов часто приходится производить перерасчет одной концентрации в другую.
Пример 8. Рассчитать массовую долю 1,25 н. раствора фосфорной кислоты, если плотность раствора составляет 1,05 г/мл.
Решение:
ω(H3PO4) =
![]()
Объем раствора принимаем за 1 л (1000 мл). Тогда масса раствора равна:
m(р-ра) = V·ρ = 1000·1,05 = 1050 г
Фактор эквивалентности H3PO4
=
![]()
Количество вещества: n(![]() H3PO4)
= C(
H3PO4)
= C(![]() H3PO4)·V
= 1,25·1 = 1,25 моль
H3PO4)·V
= 1,25·1 = 1,25 моль
Масса H3PO4 в растворе:
m(H3PO4) = n(![]() H3PO4)·M(
H3PO4)·M(![]() H3PO4)
= n(
H3PO4)
= n(![]() H3PO4)·
H3PO4)·![]() ·M(H3PO4)
·M(H3PO4)
m(H3PO4) = 1,25·![]() ·98
= 40,83 г
·98
= 40,83 г
Массовая доля H3PO4 в растворе:
ω(H3PO4) =
![]() = 0,039 или 3,9%
= 0,039 или 3,9%
Ответ: ω(H3PO4) = 0,039 или 3,9%.
Пример 9. Смешали 3 литра раствора H3PO4 (C(H3PO4) = 0,1 моль/л) и 2 литра раствора H3PO4 (ω(H3PO4) = 90%, ρ = 1,05 г/мл). Вычислить молярную концентрацию и молярную концентрацию эквивалента полученного раствора (контракцией можно пренебречь).
Решение:
Фактор эквивалентности H3PO4
=
![]()
С(H3PO4) =
![]()
С(![]() H3PO4)
=
H3PO4)
=
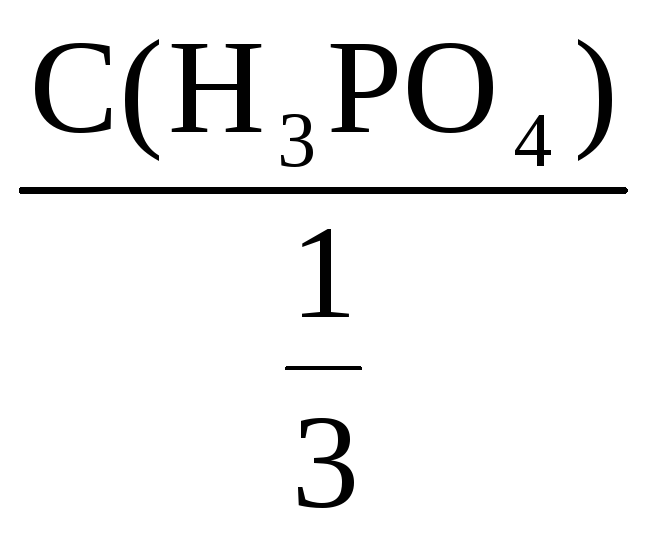 = 3·С(H3PO4)
= 3·С(H3PO4)
Поскольку по условию задачи контракцией пренебрегаем, то:
V = V1 +V2 = 3,0 + 2,0 = 5,0 л
Количества вещества в полученном растворе определяется по формуле:
n(H3PO4) = n1(H3PO4) + n2(H3PO4)
Количества вещества в первом исходном растворе:
n1(H3PO4) = C(H3PO4)·V1 = 0,1·3 = 0,3 моль
Количества вещества во втором исходном растворе:
n2(H3PO4) =
![]() =
=
![]() =
=
![]() = 1,928 моль
= 1,928 моль
Отсюда n(H3PO4) = 0,3 + 1,928 = 2,228 моль
С(H3PO4) =
![]() = 0,446 моль/л
= 0,446 моль/л
С(![]() H3PO4)
= 3·0,446 = 1,337 моль/л
H3PO4)
= 3·0,446 = 1,337 моль/л
Ответ: молярная концентрация полученного раствора H3PO4 равна 0,446 моль/л, молярная концентрация эквивалента этого раствора равна 1,337 моль/л.
