
- •Федеральное агентство по образованию
- •Концентрации растворов
- •Содержание
- •2. 5. Задания для самостоятельной работы……………………………………………………21
- •1. Расчет массовой доли растворенного вещества
- •1. 1. Вычисление массы растворенного вещества или растворителя по массе раствора
- •1. 2. Вычисление массы раствора определенной концентрации по заданной массе растворенного вещества или растворителя
- •1. 3. Разбавление и концентрирование растворов
- •1. 4. Расчеты, связанные со смешиванием растворов
- •1. 5. Задания для самостоятельной работы
- •2. Молярная концентрация
- •2. 1. Определение молярной концентрации вещества с(х) по массе вещества и массы вещества по заданной молярной концентрации
- •2. 2. Расчеты, связанные с разбавлением и концентрированием растворов
- •2. 3. Расчеты, связанные со смешиванием растворов различной концентрации
- •2. 4. Расчеты материального баланса химических процессов: избыток (недостаток) реагентов
- •2. 5. Задания для самостоятельной работы
- •Литература
2. Молярная концентрация
Молярная концентрация (молярность) – это количество моль вещества, содержащееся в 1 литре раствора.
С(Х) =
![]() ,
моль/л
,
моль/л
где Х – количество вещества, моль;
V – объем раствора, л.
Объем раствора связан с массой раствора следующим образом:
V =
![]() ,
мл,
,
мл,
где ρ – плотность раствора, г/мл.
Молярная концентрация эквивалента – это количество моль вещества эквивалента, содержащееся в 1 литре раствора.
С(![]() Х)
=
Х)
=
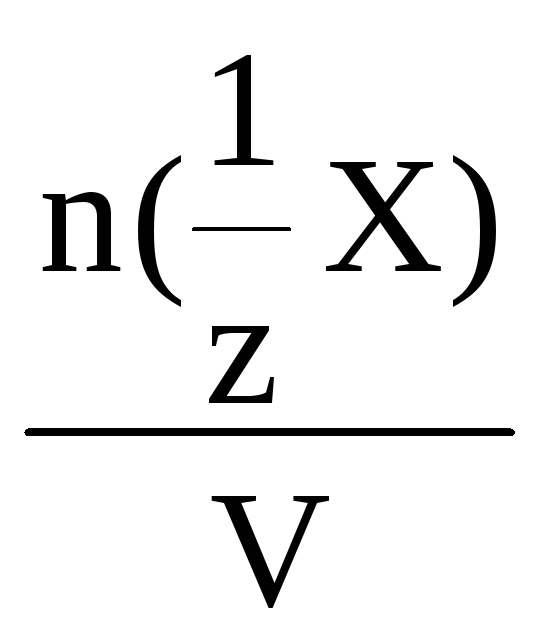 ,
моль/л
,
моль/л
где n(![]() Х)
– количество вещества эквивалента,
моль;
Х)
– количество вещества эквивалента,
моль;
V – объем раствора, л.
n(![]() Х)
=
Х)
=
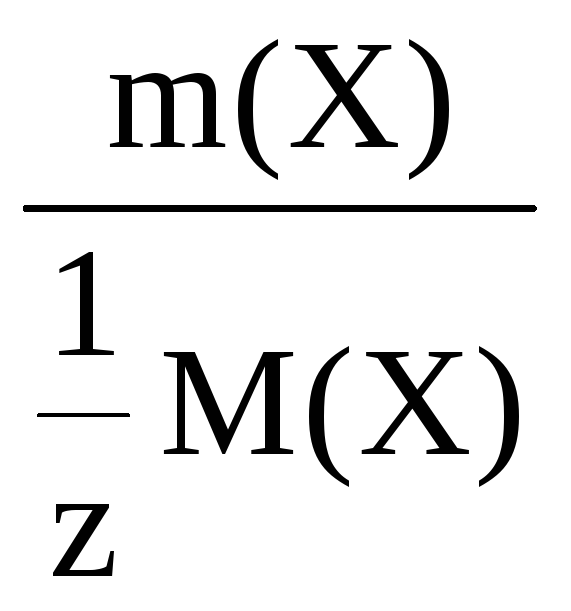 =
=
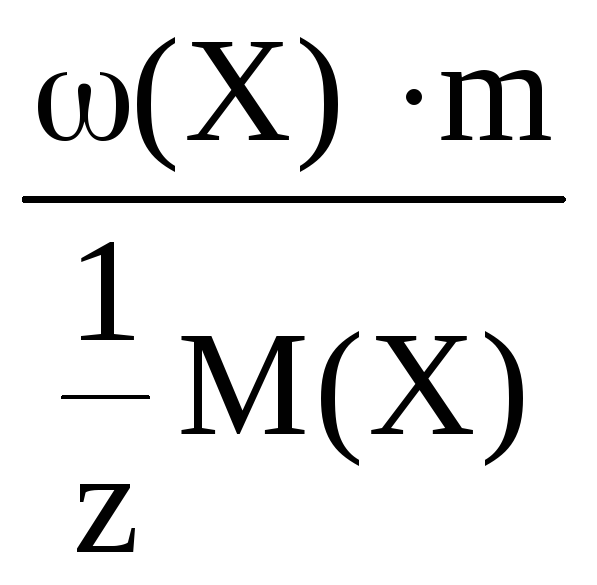
где m(X) – молярная масса растворенного вещества;
m(X) – масса растворенного вещества;
m – масса раствора;
ω(Х) – массовая доля раствора.
Молярная концентрация эквивалента всегда больше или равна молярной концентрации. Это положение используется при проверке полученных данных.
С(![]() Х)
=
Х)
=
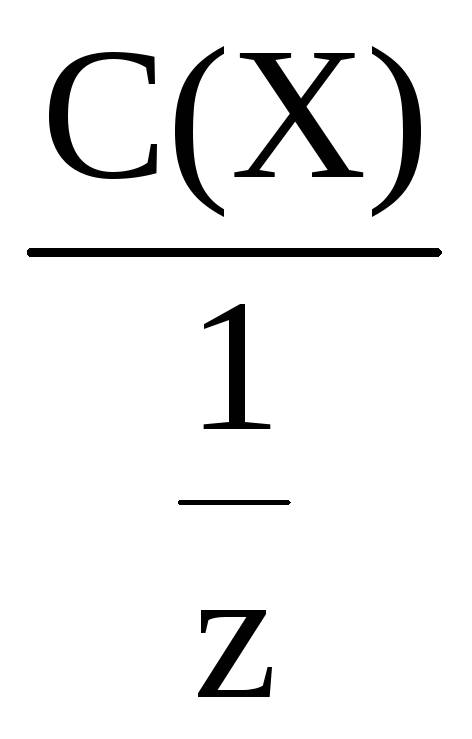
Молярную концентрацию эквивалента часто называют нормальной и обозначают 1,0 н.; 0,5 н. и т.д.
Приведенные выше расчетные формулы позволяют определять объем раствора, количество вещества и количество вещества эквивалента:
V =
![]() или V
=
или V
=
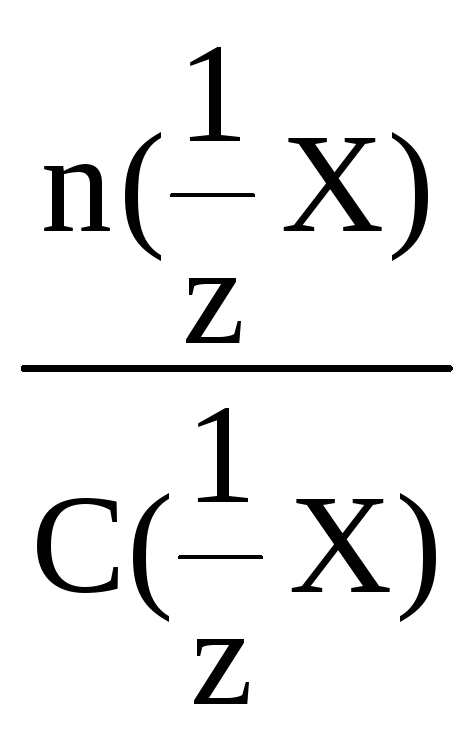
n(X) = C(X)·V или n(![]() X)
= C(
X)
= C(![]() X)·V
X)·V
2. 1. Определение молярной концентрации вещества с(х) по массе вещества и массы вещества по заданной молярной концентрации
Пример 1. Рассчитать молярную концентрацию и молярную концентрацию эквивалента K2CrO4, если в 0,55 л раствора растворено 14,7 г вещества (реакции обменные).
Решение:
С(K2CrO4) =
![]() =
=
![]() =
=
![]() = 0,14 моль/л
= 0,14 моль/л
Далее определяем фактор эквивалентности
K2CrO4, он равен
![]() .
.
С(![]() K2CrO4)
=
K2CrO4)
=
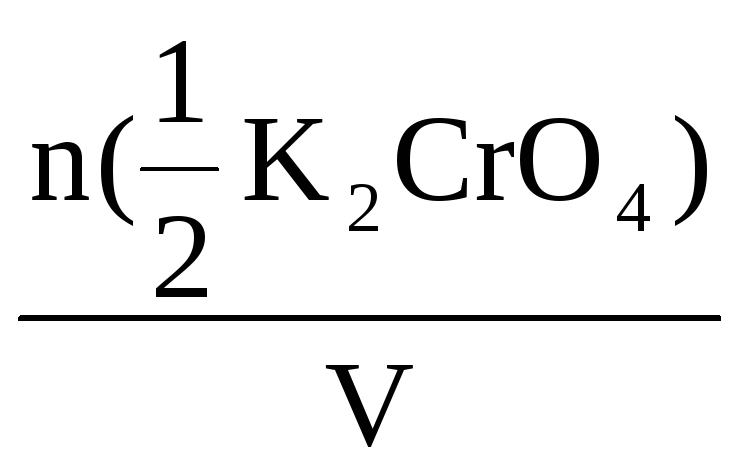 =
=
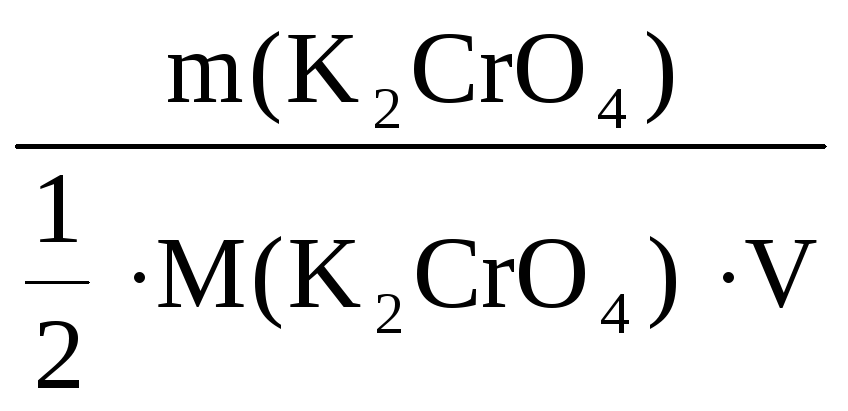 =
=
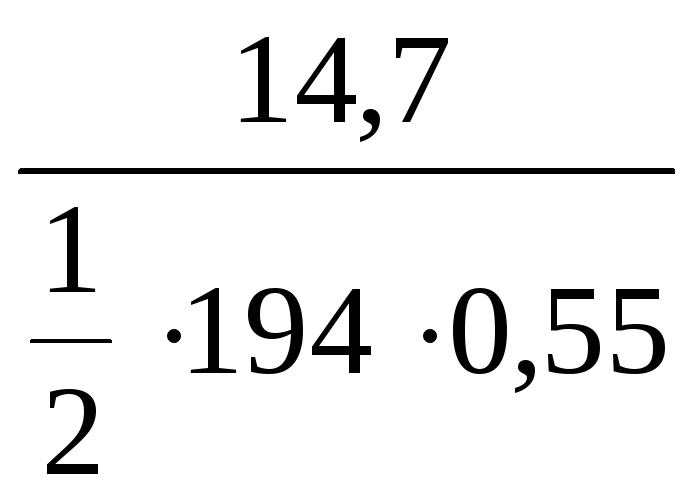 = 0,28 моль/л
= 0,28 моль/л
или С(![]() K2CrO4)
= z·С(K2CrO4) = 0,14·2 = 0,28 моль/л.
K2CrO4)
= z·С(K2CrO4) = 0,14·2 = 0,28 моль/л.
Ответ: С(K2CrO4) = 0,14 моль/л;
С(![]() K2CrO4)
= 0,28 моль/л
K2CrO4)
= 0,28 моль/л
Пример 2. Определить массу вещества, содержащегося в 200 мл раствора нитрата никеля с молярной концентрацией С(Ni(NO3)2) = 0,125 моль/л.
Решение:
m(Ni(NO3)2) = n(Ni(NO3)2)·m(Ni(NO3)2)
Объем раствора необходимо перевести в литры: 200 мл = 0,2 л.
n(Ni(NO3)2) = C(Ni(NO3)2)·V = 0,125·0,2 = 0,025 моль
m(Ni(NO3)2) = 0,025·183 = 4,575 г
Ответ: m(Ni(NO3)2) = 4,575 г.
Пример 3. Рассчитать молярную концентрацию эквивалента в растворе HCl. ω(HCl) = 25%, ρ = 1,15 г/мл.
Решение:
С(HCl) =
![]() =
=
![]()
m(HCl) = ω(HCl)·m(р-ра) = ω(HCl)·V(р-ра) ρ
Если объем раствора не задан, то удобно принимать его равным 1 л (1000 мл).
m(HCl) = 0,25·1000·1,15 = 287,5 г
С(HCl) =
![]() = 7,877 моль/л
= 7,877 моль/л
Фактор эквивалентности HCl = 1, поэтому молярная концентрация и молярная концентрация эквивалента равны.
Ответ: молярная концентрация эквивалента С(HCl) = 7,877 моль/л.
Пример 4. В 0,6 л воды растворили 100 л бромоводорода. Рассчитать С(HBr) в растворе, если ρ = 1,15 г/мл.
Решение:
С(HBr) =
![]()
Рассчитываем количество вещества бромоводорода:
n(HBr) =
![]() =
=
![]() =
4,464 моль
=
4,464 моль
Рассчитываем объем раствора:
V =
![]() =
=
![]() =
=
![]()
V =
![]() = 836 мл = 0,836 л
= 836 мл = 0,836 л
Находим молярную концентрацию раствора HBr:
С(HBr) =
![]() = 5,34 моль/л
= 5,34 моль/л
Ответ: С(HBr) = 5,34 моль/л
Пример 5. Рассчитать молярную и молярную концентрацию эквивалента раствора мышьяковой кислоты (H3AsO4). Плотность раствора 1,08 г/мл, массовая доля H3AsO4 9%.
Решение:
Фактор эквивалентности H3AsO4
=
![]()
С(H3AsO4) =
![]() С(
С(![]() H3AsO4)
=
H3AsO4)
=
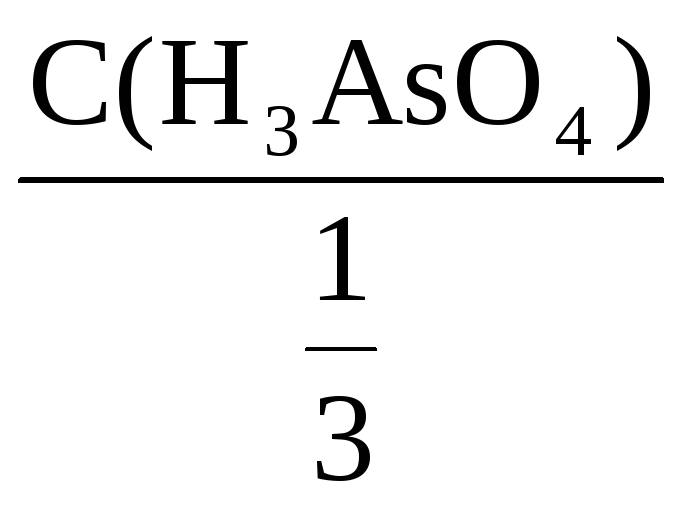 = 3С(H3AsO4)
= 3С(H3AsO4)
Объем раствора принимаем равным 1 л = 1000 мл.
m(H3AsO4) = V·ρ·ω(H3AsO4) = 1000·1,08·0,09 = 97,2 г
n(H3AsO4) =
![]() =
=
![]() = 0,68 моль
= 0,68 моль
С(H3AsO4) =
![]() = 0,68 моль/л; С(
= 0,68 моль/л; С(![]() H3AsO4)
= 3·0,68 = 2,04 моль/л
H3AsO4)
= 3·0,68 = 2,04 моль/л
Ответ: С(H3AsO4) = 0,68 моль/л,
С(![]() H3AsO4)
= 2,04 моль/л
H3AsO4)
= 2,04 моль/л
