
- •1) Предмет и методы химической термодинамики. Взаимосвязь между
- •2) Основные понятия термодинамики. Интенсивные и экстенсивные
- •3) Типы термодинамических систем (изолированные, закрытые, открытые).
- •4) Типы термодинамических процессов (изотермические, изобарные,
- •5) Первое начало термодинамики.
- •6) Энтальпия. Стандартная энтальпия образования вещества, стандартная энтальпия сгорания вещества. Стандартная энтальпия реакции.
- •Способы расчета стандартной энтальпии химической реакции
- •7) Закон Гесса.
- •8) Применение первого начала термодинамики к биосистемам. (?)
- •9) Второе начало термодинамики. Обратимые и необратимые в
- •10) Энергия Гиббса. Прогнозирование направления самопроизвольно
- •11) Стандартная энергия Гиббса образования вещества, стандартная энергия
- •12) Понятие экзергонических и эндергонических процессов, протекающих в
- •17) Уравнения изотермы и изобары химической реакции.
- •18) Предмет химической кинетики.
- •19) Скорость реакции, средняя скорость реакции в интервале, истинная
- •20) Классификации реакций, применяющиеся в кинетике: реакции,
- •21) Молекулярность элементарного акта реакции.
- •27) Экспериментальные методы определения скорости и константы
- •28) Зависимость скорости реакции от температуры. Правило Вант-
- •29) Уравнение Аррениуса. Энергетический профиль реакции; энергия
- •30) Понятие о теории активных соударений.
- •31) Роль стерического фактора.
- •32) Понятие о теории переходного состояния.
- •33) Катализ. Гомогенный и гетерогенный катализ. Энергетический
- •34) Особенности каталитической активности ферментов. Уравнение
- •32) Понятие о теории переходного состояния (более полная версия научным языком).
29) Уравнение Аррениуса. Энергетический профиль реакции; энергия
активации.
Более точно зависимость скорости реакции от температуры выражается уравнением Аррениуса. Уравнение Аррениуса в дифференциальной форме:
![]()
Энергия активации - та избыточная энергия (по сравнению со средней энергией молекул), которой должны обладать сталкивающиеся молекулы, чтобы быть способными к химической реакции (рис.)
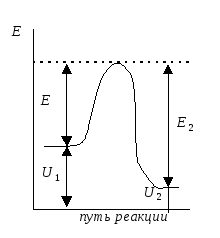
Рис.
Энергетический
профиль
реакции. Е1
и Е2
энергии активации прямой и обратной
реакций.
ΔU=U2
– U1
- тепловой эффект реакции.
Энергетический профиль реакции - график зависимости потенциальной энергии от координаты реакции
Активация вызывается повышением температуры, действием электрического поля, действием квантов света и т.д. Энергия активации Еа постоянна в данном температурном интервале и определяется механизмом реакции. Её можно определить графически по уравнению Аррениуса в линейной форме.
ln
k=![]() или
или
![]()
где А – предэкспоненциальный множитель.
где kск константа скорости реакции
Т- температура
R – универсальная газовая постоянная: R=8,314 Дж/моль∙К
Еа - энергия активации.
30) Понятие о теории активных соударений.
Для того чтобы произошла химическая реакция, необходимо, чтобы частицы столкнулись. Скорость реакции пропорциональна общему числу двойных столкновений в единицу времени в единице объема
w=qzобщ,
где q – коэффициент пропорциональности.
В теории соударений используются следующие допущения:
-
Частицы бесструктурны – это шары с радиусом r;
-
В момент соударения молекулы ведут себя как упругие шары. Т.е. суммарная энергия молекул до и после соударения остается постоянной, но может перераспределяться между молекулами.
-
Реагируют только молекулы, которые обладают энергией активации.
-
Число двойных активных столкновений определяется соотношением:
![]() ,
,
где zобщ – общее число столкновений,
zакт – число активных столкновений,
![]() -
доля активных столкновений, равная
множителю Больцмана
-
доля активных столкновений, равная
множителю Больцмана
![]() .
Он тем меньше, чем больше энергия
активации.
.
Он тем меньше, чем больше энергия
активации.
-
Процесс превращения исходных веществ в продукты происходит мгновенно в момент соударения активных молекул.
-
Скорость реакции А+В=С определяется выражением
![]() ,
,
где Р – стерический фактор.
Недостатки теории активных соударений:
-
бесструктурность частиц – они рассматриваются как шары
-
элементарный акт рассматривается как мгновенный, в действительности это сложный процесс перераспределения связей, требующий определенного времени.
Теория активных соударений объясняет много разнообразных факторов, но не объясняет влияния на скорость реакции растворителя, давления, добавок инертных газов, не позволяет сделать теоретическую оценку стерического фактора.
31) Роль стерического фактора.
Стерический
фактор
характеризует вероятность реакции
между молекулами, энергия которых
![]() и
учитывает необходимость определенной
ориентации реакционноспособных молекул
в момент столкновения.
и
учитывает необходимость определенной
ориентации реакционноспособных молекул
в момент столкновения.
