
- •1) Предмет и методы химической термодинамики. Взаимосвязь между
- •2) Основные понятия термодинамики. Интенсивные и экстенсивные
- •3) Типы термодинамических систем (изолированные, закрытые, открытые).
- •4) Типы термодинамических процессов (изотермические, изобарные,
- •5) Первое начало термодинамики.
- •6) Энтальпия. Стандартная энтальпия образования вещества, стандартная энтальпия сгорания вещества. Стандартная энтальпия реакции.
- •Способы расчета стандартной энтальпии химической реакции
- •7) Закон Гесса.
- •8) Применение первого начала термодинамики к биосистемам. (?)
- •9) Второе начало термодинамики. Обратимые и необратимые в
- •10) Энергия Гиббса. Прогнозирование направления самопроизвольно
- •11) Стандартная энергия Гиббса образования вещества, стандартная энергия
- •12) Понятие экзергонических и эндергонических процессов, протекающих в
- •17) Уравнения изотермы и изобары химической реакции.
- •18) Предмет химической кинетики.
- •19) Скорость реакции, средняя скорость реакции в интервале, истинная
- •20) Классификации реакций, применяющиеся в кинетике: реакции,
- •21) Молекулярность элементарного акта реакции.
- •27) Экспериментальные методы определения скорости и константы
- •28) Зависимость скорости реакции от температуры. Правило Вант-
- •29) Уравнение Аррениуса. Энергетический профиль реакции; энергия
- •30) Понятие о теории активных соударений.
- •31) Роль стерического фактора.
- •32) Понятие о теории переходного состояния.
- •33) Катализ. Гомогенный и гетерогенный катализ. Энергетический
- •34) Особенности каталитической активности ферментов. Уравнение
- •32) Понятие о теории переходного состояния (более полная версия научным языком).
17) Уравнения изотермы и изобары химической реакции.
Уравнение изотермы химической реакции:
ΔGх.р. = - RT ln Kp + RT ln (РDd ·PCc / РAa ·PBb)
R- газовая постоянная, R=8,314 Дж/(моль К).
Kp –константа равновесия
РD , РС - неравновесные давления газообразных продуктов реакции
РА , РB - неравновесные давления газообразных исходных веществ.
- RT ln Kp= ΔG0298, х.р.
Уравнение изобары химической реакции:
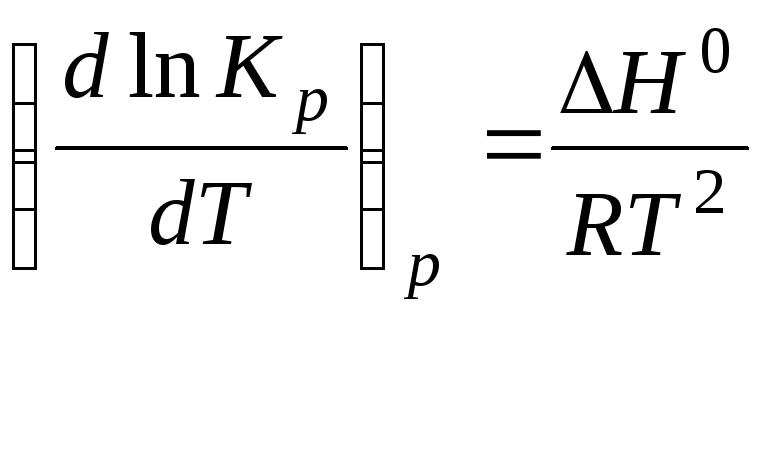 ,
,
где R- газовая постоянная, R=8,314 Дж/(моль К);
Kp – константа равновесия, выраженная через давления;
Т – температура;
∆Н – тепловой эффект реакции.
Интегральная форма уравнения изобары
![]()
К1, К2 –константы химического равновесия реакции при температурах Т1 и Т2.
18) Предмет химической кинетики.
Химическая кинетика – это учение о скорости и механизме химических реакций. Химическая кинетика изучает закономерности протекания химических процессов во времени
19) Скорость реакции, средняя скорость реакции в интервале, истинная
скорость.
Скорость реакции – это изменение концентрации реагирующих веществ в единицу времени:
![]() .
.
Поскольку скорость реакции - величина положительная, то “+” ставится, если используется концентрация продуктов реакции, и “-” - для исходных веществ.
Средняя скорость в интервале – изменение концентрации реагирующих веществ за некоторый промежуток времени:
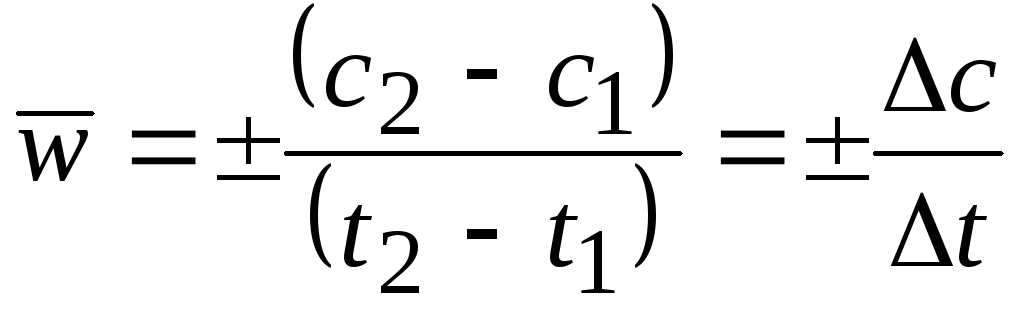 ,
,
Средняя
скорость относится к средней концентрации
![]()
Истинная скорость – изменение концентрации реагирующих веществ в конкретный момент времени и представляет собой предел средней скорости при Dt®0
![]() ,
,
20) Классификации реакций, применяющиеся в кинетике: реакции,
гомогенные, гетерогенные и микрогетерогенные(?); реакции простые и
сложные (параллельные, последовательные, сопряженные, цепные).
Гомогенными системами называются однофазные системы. ( Фазой называется однородная часть системы. Фазы отделяются друг от друга поверхностью раздела).
Гетерогенными системами называются системы, образованные двумя и более фазами.
Простыми называют реакции, протекающие в одну стадию.
Сложными называют реакции, протекающие в несколько стадий.
Выделяют следующие виды сложных реакций: параллельные, последовательные, сопряженные, цепные.
Параллельные реакции - реакции, в которых исходные вещества способны образовывать разные продукты реакции или одно вещество одновременно способно реагировать с несколькими веществами.
Последовательные реакции - химические процессы, в которых продукт одной реакции является исходным веществом др. реакции.
Сопряжённые реакции - это такие реакции химические, которые протекают только совместно и при наличии хотя бы одного общего реагента.
Цепные реакции – это хим. превращения и ядерные процессы, в которых появление промежуточной активной частицы (свободного радикала, атома, возбужденной молекулы в хим. превращениях, нейтрона - в ядерных процессах) вызывает цепь превращений исходных в-в. Примеры хим. цепных реакций- радикальная полимеризация, окисление, пиролиз и галогенирование углеводородов и др. орг. соед.; ядерные цепные процессы - цепное деление атомных ядер.
