
- •Индивидуальные задания по физической и коллоидной химии
- •430005 Саранск, ул. Советская, 24 предисловие
- •Т е м а: Химическая термодинамика Примеры решения задач
- •Вопросы и задания
- •Т е м а: Химическая кинетика Примеры решения задач
- •Т е м а: Растворы Примеры решения задач
- •Вопросы и задания
- •Т е м а: Электропроводность растворов Примеры решения задач
- •Вопросы и задания
- •Т е м а: Электродные потенциалы и электродвижущие силы Примеры решения задач
- •Вопросы и задания
- •Т е м а: Физико-химия поверхностных явлений Примеры решения задач
- •Вопросы и задания
- •Т е м а: Физико-химия дисперсных систем Примеры решения задач
- •Вопросы и задания
- •Библиографический список
- •Содержание
Т е м а: Химическая кинетика Примеры решения задач
Задача 1. Температурный коэффициент скорости реакции гидролиза некоторого лекарственного препарата равен 2,5. При какой температуре нужно провести его “искусственное старение”, чтобы скорость разрушения препарата возросла в 10 раз? (Рекомендуемая температура хранения 20 С).
Решение
Согласно правилу Вант–Гоффа при увеличении температуры на каждые 10 скорость реакции возрастает в 2 4 раза:
![]() =
=
 = n,
= n,
где n =
![]()
Так как отношение скоростей при Т2 и Т1 = 293 К равно 10, а = 2,5,
то рассчитаем величину n:
n = 10; 2,5n = 10.
Прологарифмируем данное выражение:
n lg 2,5 = lg 10,
n =
![]() =
=
![]() = 2,5.
= 2,5.
T2 = 10n + T1 = 102,5 + 293 = 318,1 K (45,1C).
Задача 2. Хлористый фенилдиазоний при 50 C в воде подвергается термическому распаду по уравнению первого порядка с константой скорости равной 0,07 мин–1. Сколько времени нужно нагревать раствор при указанной температуре, чтобы исходная концентрация вещества, равная 0,01 моль/л, уменьшилась в 10 раз? Чему равен период полураспада фенилдиазония при 50 C?
Решение
Запишем выражение для константы скорости реакции первого порядка:
k =
![]() lg
lg
![]() .
.
Отсюда t =
![]() lg
lg
![]()
Текущая концентрация будет равна: С
=
![]() = 0,10,01 = 0,001 моль/л
= 0,10,01 = 0,001 моль/л
t =
![]() lg
lg
![]() = 32,86 мин.
= 32,86 мин.
Период полураспада, т. е. время, за которое начальная концентрация уменьшается в 2 раза, для реакции первого порядка рассчитываем по формуле
1/2 =
![]() =
=
![]() = 9,86 мин.
= 9,86 мин.
Задача 3. Рассчитайте энергию активации реакции, для которой при повышении температуры с 295 до 305 К скорость реакции удваивается.
Решение
Используем уравнение Аррениуса в интегральной форме:
lg
![]() =
=
![]() (
(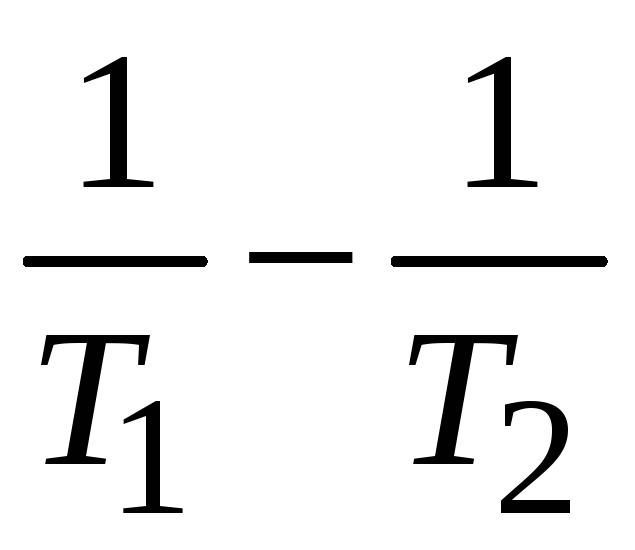 );
);
Если скорость реакции удваивается, то
 ;
;
E =
 =
=
![]() = 51,59 кДж/моль.
= 51,59 кДж/моль.
Вопросы и задания
1. Дайте определение понятия скорости химической реакции и перечислите факторы, влияющие на ее величину.
2. Сформулируйте закон действующих масс для скорости химической реакции. Каков физический смысл константы скорости реакции?
3. Что понимают под молекулярностью и порядком химической реакции? Всегда ли они совпадают? Приведите примеры.
4. Какие реакции относятся к реакциям первого порядка? Приведите уравнение для расчета константы скорости этих реакций.
5. Какие реакции называются реакциями нулевого порядка? Приведите уравнение для расчета константы скорости.
6. Какие реакции относятся к реакциям второго порядка? Приведите уравнения для расчета константы скорости этих реакций.
7. Что называется периодом полураспада? Покажите характер зависимости периода полураспада от начальной концентрации в реакциях нулевого, первого и второго порядков.
8. Какие экспериментальные данные необходимо иметь для определения константы скорости?
9. Как влияет температура на скорость химической реакции? Изобразите графически известные вам зависимости скорости от температуры.
10. Напишите кинетическое уравнение реакции:
FeCl3 + 3 KNCS = 3 KСl + Fe(NCS)3,
если известно, что она имеет первый порядок по концентрациям обоих реагирующих веществ.
11. Какими уравнениями описывается влияние температуры на скорость реакции?
12. В чем заключаются особенности влияния температуры на скорость реакций, протекающих в живых организмах (биологических системах)?
13. Приведите график изменения энергии системы в ходе химической реакции.
14. Какие экспериментальные данные необходимо иметь для определения энергии активации?
15. Приведите примеры простых и сложных реакций. Какие типы сложных реакций вам известны?
16. Какие реакции называются цепными? В чем заключаются их особенности?
17. Сопоставьте действия неорганических катализаторов и ферментов.
18. Столкновение каких молекул, согласно теории Аррениуса, приводит к химическому превращению? Влияют ли на скорость реакции стерические факторы? Обоснуйте ваш ответ.
19. Чем отличаются, согласно теории Аррениуса, активные молекулы от неактивных и как можно рассчитать долю активных молекул?
20. Объясните суть теории активированного комплекса.
21. Применительно к процессам всасывания лекарственных препаратов из желудка в кровь и выведения их в мочу используют термин “время полувыведения”. Константа скорости процесса выведения лекарства из организма называется константой элиминации. Она является характеристикой препарата и для разных препаратов имеет значения 10–5 – 10–3 с–1. Рассчитайте время полувыведения препарата, если константа элиминации равна 610–5 с–1, а процесс выведения протекает по первому порядку. (11500 с.)
22. В чем физический смысл понятия “энергия активации”? Объясните в рамках теории Аррениуса влияние температуры на скорость реакции.
23. Скорость оседания эритроцитов (СОЭ)
описывается кинетическим уравнением
![]() ,
где
,
где
![]() –
концентрация эритроцитов в плазме
крови. Тангенс угла наклона прямой,
построенной в координатах
–
концентрация эритроцитов в плазме
крови. Тангенс угла наклона прямой,
построенной в координатах
![]() =
f (t), равен 10–13л/(мольмин).
Объясните физический смысл этой величины.
По какому порядку протекает данный
процесс?
=
f (t), равен 10–13л/(мольмин).
Объясните физический смысл этой величины.
По какому порядку протекает данный
процесс?
24. Энергия активации для реакции распада пероксида водорода под действием иона железа (II) и молекулы каталазы соответственно равна 42 и 7,1 кДж/моль. В каком случае разложение H2О2 произойдет быстрее и почему?
25. Можно ли по написанному уравнению химической реакции установить кинетический порядок реакции?
26. Как влияет катализатор на величину энергии активации реакции и на равновесие?
27. Какие реакции называются каталитическими? Приведите примеры таких реакций в живых организмах.
28. Есть ли отличия между реакциями первого и второго порядков?
29. Имеют ли отношение фотохимические реакции к механизму действия зрительного анализатора? Ответ обоснуйте.
30. Какие реакции называются цепными? Приведите примеры.
31. Объясните физический смысл константы скорости реакции. От каких факторов зависит ее величина?
32. Константа скорости некоторой реакции имеет размерность л/(мольс). Каков порядок этой реакции? Ответ обоснуйте.
33. Является ли образование кислорода как побочного (но очень важного) продукта фотосинтеза универсальным свойством фотосинтеза? Ответ обоснуйте.
34. Какие теории катализа вам известны? Каковы основные положения этих теорий?
35. Покажите роль фермент-субстратного комплекса в ферментативном катализе.
36. Обычный путь лекарственных веществ в организме можно рассматривать как последовательность двух процессов: всасывание из желудка в кровь и выведение из крови в мочу. Каждый из этих процессов характеризуются константами скоростей. Изобразите кинетические кривые изменения массы лекарственного вещества в желудке, крови и моче. Как можно использовать эти зависимости для прогнозирования дозы и частоты приема лекарственного вещества?
37. Приведите основные стадии процесса фотосинтеза. В чем состоит сущность фотохимической реакции?
38. Что понимают под положительным и отрицательным катализом? Приведите примеры.
39. В чем проявляется специфичность и избирательность катализаторов? Покажите это на конкретных примерах.
40. Объясните влияние pH среды на ферментативную активность.
41. Известно, что согласно закону Эйнштейна один поглощенный квант энергии вызывает единственный химический процесс. В то же самое время квантовый выход может быть равен 106. Как объяснить это кажущееся противоречие?
42. Какая разница между молекулярностью и кинетическим порядком реакции? Может ли кинетический порядок реакции быть равен молекулярности?
43. Во сколько раз скорость реакции разложения пероксида водорода под действием каталазы (k2 = 3,5107 с–1) больше скорости той же реакции, но под действием иона Fe2+ (k1 = 56,0 с–1)? Как будут соотноситься между собой энергии активации данных процессов?
44. Можно ли предсказать по уравнению реакции зависимость ее скорости от концентрации?
45. Какие факторы влияют на скорость ферментативной реакции? В чем физический смысл константы Михаэлиса?
46. В лабораторных условиях кислород часто получают разложением бертолетовой соли в присутствии оксида марганца (IV) в качестве катализатора. Какой это тип катализа гетерогенный или гомогенный?
47. Что называется квантовым выходом фотохимической реакции?
48. Объясните возможные изменения константы скорости реакции при проведении ее в присутствии катализатора.
49. Почему при повышении температуры скорость реакции увеличивается независимо от того, проходит она с выделением или поглощением теплоты?
50. Жиры и углеводы окисляются в живом организме при температуре около 37 С, а вне его их окисление происходит при 450 – 500 С. Объясните причины этого явления.
51. Реакция первого порядка протекает на 30 % за 60 мин. За какое время реакция завершится (время разложения 99,9% вещества)? (1163 мин)
52. Реакция А + В → 2D второго порядка. Если начальные значения концентрации реагентов равны, то за 300 с реакция проходит на 20 %. За какое время она пройдет на 70 %? (2800 с)
53. Рассчитайте, при какой температуре реакция практически закончится через 15 мин, если при 293 К на это потребуется 2 ч. Температурный коэффициент реакции равен 3. (312 К)
54. Как изменится скорость элементарной гипотетической реакции M + 3L = 2D, если концентрацию вещества M увеличить в 4 раза, а концентрацию вещества L уменьшить во столько же раз? (Уменьшится в 16 раз)
55. Сопоставьте константы скорости двух
реакций первого порядка
![]() и
и
![]() ,
если период полураспада первой реакции
в три раза больше, чем второй. (1:3.)
,
если период полураспада первой реакции
в три раза больше, чем второй. (1:3.)
56. При авариях на атомных станциях часто происходит выброс изотопа йода с массовым числом 131. Период полураспада этого изотопа равен 8 сут. За какое время произойдет разложение изотопа йода на 90 %? (26,8 сут)
57. Разложение пероксида водорода в водном растворе протекает как реакция первого порядка с периодом полураспада 13,6 мин. Определите время, которое потребуется для разложения при аналогичных условиях 90 % пероксида водорода. (46 мин)
58. При 20 С 0,01 М раствор уксусноэтилового эфира омыляется 0,02 М раствором NаОH на 10 % в течение 23 мин. Как изменится это время, если уменьшить концентрации реагирующих веществ в пять раз? (115 мин)
59. Скорость бактериального гидролиза мышц рыб удваивается при переходе от температуры –1,1 С к температуре +2,2 С. Оцените энергию активации этой реакции. Есть ли здесь какая-нибудь связь с проблемой хранения рыбы? (130,08 кДж/моль)
60. Скорость многих реакций удваивается при повышении температуры на каждые 10 градусов. Считая, что такая реакция идет при 300 К, оцените, какова должна быть энергия активации, чтобы эта закономерность выполнялась. (53,35 кДж/моль)
61. Диссоциация фосгена COCl2 = CO + Cl2 при температуре 109 С протекает с константой скорости 510–3 мин–1. Какое количество фосгена разложится при данной температуре за 100 мин после начала реакции, если начальная концентрация фосгена составила 1 моль/л? (0,396 моль)
62. Срок годности некоторого лекарственного препарата при 40 С равен 1 году. Определите срок годности его при комнатной температуре (20 C), если считать, что разложение его идет по первому порядку и температурный коэффициент равен 2. (4 года)
63. Денатурация белка (реакция 1-го порядка) при 60 С прошла за 15,32 мин. на 50 %. Определите время его распада на 90 % при этих же условиях. Можно ли получить ответ задачи, если в условии вместо периода полураспада, известны энергия активации и константа скорости при 20 С? (51 мин.)
64. Константа разложения таблеток анальгина при 20 С равна 1,510–9 с–1. Рассчитайте срок хранения таблеток (время разложения 10 % вещества) в этих условиях. (2,23 года)
65. Появление изотопов азота наблюдается при ядерных взрывах. Один из таких изотопов имеет период полураспада 9,93 ч. Какая часть данного изотопа распадается через сутки после начала процесса? (0,81)
66. Какой должна быть энергия активации, чтобы скорость реакции увеличилась в три раза при повышении температуры от 50 до 60 С? (98,24 кДж/моль)
67. В сосуде имеется 0,025 г радона. Период полураспада радона 3,82 дня. Какое количество радона (%) останется в сосуде через 2 недели? (8 %)
68. Фармацевтический препарат этилхлорид вызывает временную анестезию. При гидролизе (в среде 80%-го этилового спирта) обнаружено, что изменение его концентрации во времени происходит следующим образом:
|
t, ч |
0 |
4 |
10 |
27 |
37 |
|
C(С2H5Cl), моль/л |
0,312 |
0,258 |
0,186 |
0,085 |
0,047 |
Определите константу скорости и период полупревращения, если она протекает по первому порядку. (0,0496 час–1, 14 час.)
69. Спазмолитин в водном растворе при 353 К разлагается наполовину за 90 мин. Рассчитайте время, за которое спазмолитин разложится наполовину при температуре 293 К, если энергия активации этого процесса равна 75,7 кДж/моль. (12,3 дня)
70. При хранении таблеток анальгина при комнатной температуре (20 С) происходит его разложение с константой скорости 1,510–9с–1. Рассчитайте срок хранения таблеток анальгина (время разложения 10 % вещества) в этих условиях и в условиях хранения в холодильнике (–5 С), если энергия активации процесса разложения равна 60 кДж/моль. (2,23 года; 22,07 года)
71. Препарат "Калий-нормин" нормализует количество ионов калия в сыворотке крови. После приема таблеток концентрация ионов калия в сыворотке крови изменилась следующим образом:
|
t, ч |
0 |
4 |
8 |
12 |
24 |
|
C(К+), мг /л |
4,60 |
4,40 |
4,20 |
4,08 |
3,53 |
Определите константу скорости реакции распада таблеток. (0,0109 час–1)
72. Одним из опасных последствий ядерного взрыва является образование изотопа 90Sr и его внедрение в кости вместо кальция. Период полураспада изотопа равен 28,1 года. Предположим, что 1 мкг был поглощен новорожденным. Сколько останется его а) к 18 годам, б) к 70 годам? (а) 0,64 мкг; б) 0,18 мкг)
73. Реакция имеет энергию активации 64,79 кДж/моль и константу скорости реакции при 20 С равную 1,2 мин–1. Рассчитайте величину константы скорости при 0 С. (0,17 мин–1)
74. Температурный коэффициент скорости некоторой реакции равен 2. Вычислите константу скорости реакции при 390 С, если при 362 С она равна 7,510–4 с–1. (5,22·10–3 с–1)
75. Монохлоруксусная кислота при 298 К реагирует с водой (вода взята в большом избытке). Константа скорости этой реакции равна 710–5 с–1. Определите время полураспада и время, в течение которого прореагирует 75 % монохлоруксусной кислоты. (2,74 час; 5,5 час)
76. Разложение пероксида водорода в водном растворе протекает по кинетическому уравнению реакции первого порядка с константой скорости 5,08110–2 мин–1. Определите время, за которое пероксид водорода разложится на 50 %. (13,6 мин)
77. Диссоциация фосгена при температуре 109 С протекает с константой скорости 510–3 мин–1, при повышении температуры до 209 С константа скорости становится равной 6,7610–1 мин–1. Рассчитайте энергию активации процесса диссоциации фосгена и константу скорости реакции при температуре 150 С. (75,14 кДж/моль; 4,510–2 мин–1)
78. При гидролизе 1 кг сахарозы в присутствии воды и фермента гидролиза сахаразы через 5 ч осталось непрореагировавшим 600 г сахарозы. Вычислите количество сахарозы, разложившейся через 30 мин от начала реакции. (49,4 г.)
79. В условиях 40-градусной жары новокаин гидролизуется с константой скорости 0,66 ч–1. Энергия активации этого процесса равна 55,2 кДж/моль. Сколько процентов новокаина разложится за 30 дней его хранения при 40-градусном морозе? (27,85 %)
80. Для определения срока годности порошка папаверина гидрохлорида проведено исследование по методике "ускоренного старения" и получены следующие результаты:
|
время, сут |
0 |
4 |
12 |
20 |
|
(t=50 C) C, % |
100 |
99,79 |
99,38 |
98,91 |
|
(t=80 C) C, % |
100 |
99,58 |
98,86 |
97,80 |
Определите срок годности порошка (время разложения 10 % вещества) при температуре хранения 20 С. (1,22 года)
81. Реакция первого порядка при 20 С осуществляется на 40 % за 50 мин. При какой температуре реакция завершится полностью за это же время, если энергия активации составляет 36 кДж/моль. (357,15 К)
82. Содержание лекарственного препарата в растворе при гидролизе за 14 дней уменьшилось на 6,85 %. Определите константу скорости процесса, период полупpевpащения и срок хранения препарата (время разложения 10 % вещества). (0,005 дн–1; 136 дн; 21 день)
83. При хранении таблеток амидопирина было установлено, что при 80 С и 90 С константы скорости разложения соответственно равны 1,6410‑6 с–1 и 4,2010–6 с–1. Определите срок хранения таблеток (время разложения 10 % вещества) при 20 С. (2,22 года)
84. Константа скорости гидролиза новокаина при 313 К равна 0,66 ч–1, энергия активации реакции 55,2 кДж/моль. Сколько времени потребуется для разложения 50% новокаина при температуре хранения 263 К? (59 ч.)
85. Для реакции разложения сульфацила натрия при 460 К константа скорости 3,510–2 мин–1, а при 518 К она равна 3,4310–1 мин–1. Определите температурный коэффициент скорости и константу скорости реакции при 486 К. (1,48; 9,78·10–2 мин–1)
86. Температурный коэффициент скорости реакции гидролиза 5 % норсульфазола-натрия равен 3. Оптимальная температура хранения препарата 20 С При какой температуре нужно проводить "искусственное старение" препарата, чтобы скорость его разрушения возросла в 80 раз? (59,8С)
87. На основании экспериментальных данных реакции гидролиза сахарозы установлено:
|
t, С |
25 |
40 |
50 |
55 |
|
kсp, мин-1 |
9,67 |
73,40 |
268,00 |
491,00 |
Вычислите температурный коэффициент скорости реакции гидролиза сахарозы для каждого температурного интервала и средний в пределах от 25 до 55 С. (3,7)
88. Рассчитайте, во сколько раз возрастет скорость реакции при повышении температуры от 20 до 30 С, если энергия активации равна 125,6 кДж/моль. Во сколько раз возрастет скорость той же реакции при повышении температуры от 20 до 120 С? (5,46 раза; 5105 раз)
|
Варианты индивидуальных заданий для контрольной работы по теме: “Растворы” |
Номера вопросов |
Последняя цифра |
9 |
21, 22, 32, 64, 70 |
6, 7, 29, 60, 85 |
40, 41, 47, 63, 88 |
11, 42, 48, 49, 77 |
12, 37, 38, 67, 87 |
13, 27, 42, 59, 71 |
13, 17, 39, 44, 69 |
3, 28, 34, 66, 57 |
10, 23, 33, 53, 81 |
5, 18, 31, 68, 79 |
|
8 |
12, 20, 31, 63, 69 |
8, 25, 26, 49, 86 |
27, 38, 39, 46, 62 |
3, 5, 40, 75, 76 |
22, 36, 41, 68, 82 |
10, 14, 28, 58, 73 |
11, 23, 37, 43, 45 |
2, 16, 42, 65, 71 |
9, 18, 19, 44, 60 |
2, 4, 50, 66, 78 |
|||
|
7 |
15, 26, 42, 56, 61 |
4, 13, 48, 75, 80 |
12, 16, 36, 43, 59 |
1, 25, 37, 71, 84 |
10, 30, 33, 60, 74 |
8, 18, 29, 54, 77 |
2, 28, 35, 47, 49 |
23, 32, 41, 63, 73 |
5, 17, 31, 45, 53 |
14, 34, 40, 64, 76 |
|||
|
6 |
15, 26, 42, 56, 61 |
4, 13, 48, 75, 80 |
12, 16, 36, 43, 59 |
1, 25, 37, 71, 84 |
10, 30, 33, 60, 74 |
8, 18, 29, 54, 77 |
2, 28, 35, 47, 49 |
23, 32, 41, 63, 73 |
5, 17, 31, 45, 53 |
14, 34, 40, 64, 76 |
|||
|
5 |
10, 14, 28, 52, 59 |
11, 40, 41, 74, 79 |
15, 35, 42, 58, 87 |
34, 36, 70, 72, 88 |
21, 23, 32, 43, 49 |
7, 17, 31, 61, 78 |
1, 24, 33, 51, 82 |
8, 18, 19, 62, 76 |
6, 25, 30, 46, 75 |
31, 38, 48, 63, 71 |
|||
|
4 |
8, 13, 24, 51, 58 |
3, 38, 39, 72, 78 |
10, 28, 33, 55, 85 |
16, 27, 35, 68, 69 |
18, 20, 31, 75, 86 |
6, 25, 32, 64, 79 |
9, 42, 52, 81, 88 |
4, 17, 30, 61, 77 |
4, 15, 29, 47, 84 |
16, 26, 37, 62, 87 |
|||
|
3 |
7, 11, 23, 47, 55 |
2, 34, 37, 68, 77 |
19, 21, 24, 54, 60 |
22, 33, 41, 57, 67 |
6, 9, 29, 83, 84 |
5, 30, 50, 65, 80 |
1, 20, 38, 56, 85 |
6, 25, 31, 59, 79 |
10, 26, 51, 74, 88 |
27, 29, 39, 61, 69 |
|||
|
2 |
3, 18, 25, 46, 54 |
1, 16, 36, 67, 76 |
20, 23, 30, 49, 53 |
12, 21, 38, 56, 66 |
8, 17, 26, 80, 82 |
4, 19, 48, 62, 83 |
2, 15, 41, 57, 87 |
5, 29, 50, 58, 80 |
14, 24, 27, 52, 72 |
22, 32, 35, 57, 59 |
|||
|
1 |
2, 5, 17, 45, 53 |
19, 35, 66, 73, 88 |
9, 18, 32, 44, 82 |
15, 20, 50, 52, 65 |
7, 14, 24, 79, 81 |
27, 34, 40, 63, 86 |
3, 16, 21, 44, 69 |
6, 26, 48, 55, 83 |
13, 22, 28, 68, 70 |
12, 30, 36, 76, 85 |
|||
|
0 |
1, 4, 6, 43, 44 |
27, 30, 33, 65, 71 |
8, 17, 31, 81, 87 |
9, 10, 48, 51, 64 |
13, 28, 50, 60, 78 |
16, 39, 66, 85, 88 |
11, 22, 34, 53, 70 |
7, 14, 40, 54, 86 |
11, 12, 42, 56, 67 |
15, 19, 21, 77, 82 |
|||
|
Пред- |
послед-няя |
цифра |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
