
- •Оглавление
- •Введение
- •Внутренняя энергия газа
- •Первое начало термодинамики
- •Теплоёмкость идеального газа
- •Применение I начала к изопроцессам
- •Адиабатный процесс
- •Политропический процесс
- •Скорость звука в газах
- •II начало термодинамики
- •Статиcтический смысл II начала термодинамики
- •«Теория тепловой смерти Вселенной»
- •Круговые процессы (циклы). Работа цикла
- •Цикл Карно. Кпд тепловой машины
- •Работа бытового холодильника
- •Технические циклы
Применение I начала к изопроцессам
1.Изотермический процесс: T=const (рисунок 1)
d'Q=dU+d’A; dT=0, dU=0, следовательно d'Q=d’A. То есть, подведённая теплота полностью тратится на совершение работы, а совершаемая над газом работа выделяется в виде теплоты. Таким образом, должен быть идеальный теплообмен.



Рис. 1 Рис. 2 Рис. 3
Работа при изотермическом процессе:
d’A=PdV,![]() ,
,![]() ,
,
![]() ,
,
![]()
или
![]() ,
Для 1 моля:
,
Для 1 моля:
![]() ,
,
![]() .
.
2.Изохорный процесс: V=const (рисунок 3)
dV=0, d’A=0,d’Q=dU.
Вся подведённая теплота идёт на увеличение внутренней энергии газа .
![]() ,
,
![]() .
Для 1 моля:
.
Для 1 моля:
![]()
3.Изобарный процесс: P=const (рисунок 2)
d'Q=dU+d’A, Для 1 моля: d'Q= СvdT +PdV, d’Q идёт на увеличение внутренней энергии и работу.
 .
.
Итак:
![]() .Для 1 моля газа:
.Для 1 моля газа:
![]() .
.
Адиабатный процесс
Адиабатическим изменением состояния системы называется такое изменение, которое протекает без обмена теплом между системой и окружающими телами.
Для этого систему нужно окружить абсолютно нетеплопроводными стенками, но так как в реальности таких стенок нет, то всякий реальный адиабатный процесс - приближённый. Близки к адиабатным процессы, протекающие настолько быстро , что обмен с окружающими телами не успевает осуществиться.
Запишем I начало термодинамики: d'Q=dU+d'A, d'Q=0, dU+d'A=0 или
d'A=- dU.
Таким образом, при адиабатном процессе работа системой может совершаться лишь за счёт убыли её внутренней энергии. Если работа совершается над системой – её внутренняя энергия возрастает.
Рассмотрим процесс адиабатного расширения идеального газа.
Для 1 моля газа:
![]() ,
,
![]() ;
;
![]() =СvdT. Тогда I
начало термодинамики примет вид:
=СvdT. Тогда I
начало термодинамики примет вид:
![]() или
или
![]() .
.
При адиабатном
расширении
![]() >0
и dT<0: газ охлаждается.
>0
и dT<0: газ охлаждается.
При адиабатном
сжатии
![]() <0
и dT>0: газ нагревается.
<0
и dT>0: газ нагревается.
Таким образом, при адиабатном изменении объёма газа его температура изменяется.
Выведем уравнение адиабатного процесса. Для этого воспользуемся I началом термодинамики и уравнением Менделеева – Клапейрона. Для 1 моля газа:


![]() ,
,
![]() Делим почленно:
Делим почленно:
![]()
![]() ,
интегрируем:
,
интегрируем:
 ,
,
![]() ,
,
![]() ,
,
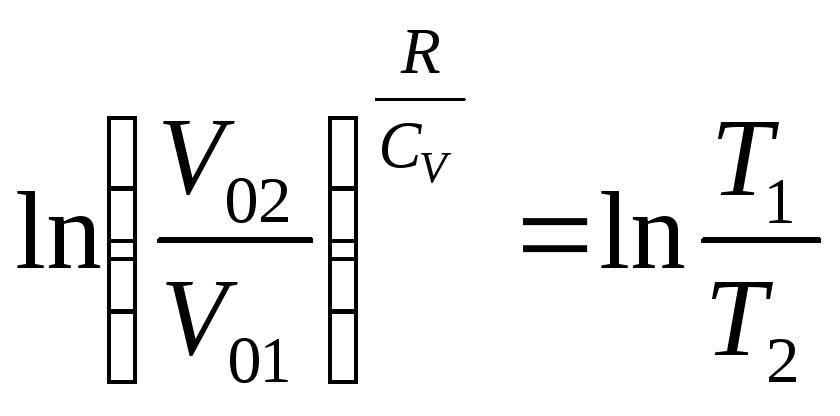 ,
,
 ,
,
![]() ,
,
 ,
,
![]() ,
(1) Для произвольной массы газа:
,
(1) Для произвольной массы газа:
![]() (2)
(2)
Преобразуем (1) с помощью уравнения Менделеева – Клапейрона:

![]() после деления:
после деления:![]() (3).
(3).
![]()
Подставим (3) в(1), получим:
![]() .
.
![]() - уравнение Пуассона (4) .
- уравнение Пуассона (4) .
Кроме (2) и
(4) уравнения адиабатного процесса можно
записать в виде:
![]() (5).
(5).
Работа при адиабатном процессе:
![]() ,
,
 .
.
Но
![]() ,
тогда:
,
тогда:
![]() .
Для произвольной массы газа:
.
Для произвольной массы газа:
![]() .
Это выражение можно преобразовать к
виду:
.
Это выражение можно преобразовать к
виду:
![]() ,
,
 .
.
Из уравнения Пуассона следует, что при адиабатном изменении объема газ не подчиняется закону Бойля - Мариотта. Адиабата круче изотермы (Рис. 4).

Рис. 4
Политропический процесс
Политропные (политропические) процессы (ПП)- это такие процессы, при которых теплоёмкость системы остаётся постоянной: C=const.
![]() ; при V=const
→
; при V=const
→
![]() ,
при P=const
→
,
при P=const
→![]() ,
при Т=const (
,
при Т=const (![]() )
)
![]() ,
при адиабатном процессе (
,
при адиабатном процессе (![]() )
)![]() = 0.
= 0.
Выведем уравнение политропы для идеального газа.
![]() (1), где
(1), где
![]() -
молярная теплоёмкость при политропном
процессе.
-
молярная теплоёмкость при политропном
процессе.
Для 1 моля газа:
![]() , (2)
, (2)
Из (2):
![]() ,
(3) обозначим
,
(3) обозначим
![]() (4)
(4)
Тогда![]() (5).
(5).
![]()
Интегрируем
(3), учтём (5) .Получим:![]() ;
Для произвольной массы газа:
;
Для произвольной массы газа:![]() (6) – это уравнение политропы
(политропного процесса).
(6) – это уравнение политропы
(политропного процесса).
Используя уравнение Менделеева – Клапейрона, из (6) получаем уравнение политропы в ином виде:
![]() (7) ,
(7) ,
![]() (8).
(8).
Используя
(4)
![]() ,
получаем:
,
получаем:
при
изотермическом процессе:
![]() ,
тогда n=1 и из (6) имеем:
Т=const.
,
тогда n=1 и из (6) имеем:
Т=const.
Для адиабатного
процесса:
![]() ,
тогда
,
тогда
![]() и из (6)имеем:
и из (6)имеем:
![]() .
Для реального процесса:1<
.
Для реального процесса:1<![]() <
<![]() .
.
Изобарный
процесс:
![]() ,
следовательно
,
следовательно
![]() .
.
Изохорный
процесс:
![]() ,
следовательно
,
следовательно
![]() .
(Из того что
.
(Из того что![]()
![]() ).
).
Работа при
политропном процессе определяется
формулами для адиабатного процесса при
замене
![]() .
.
