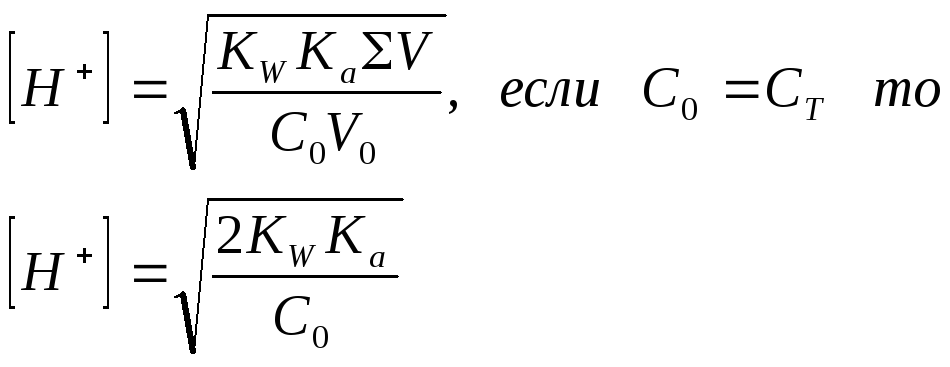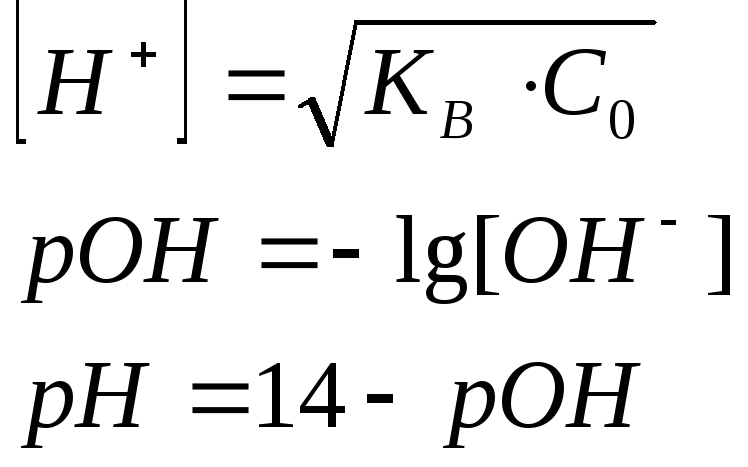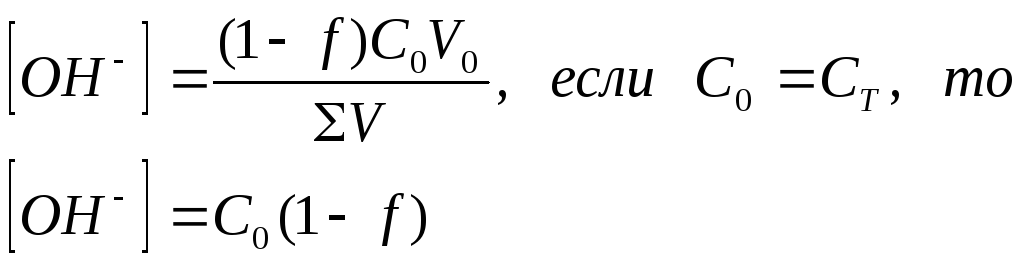- •Лабораторная работа №1 Скорость химических реакций
- •Экспериментальная часть Опыт 1. Влияние концентраций реагирующих веществ на скорость химической реакции в гомогенной системе.
- •Опыт 2. Влияние температуры на скорость химической реакции
- •Опыт 3. Влияние величины поверхности раздела реагирующих веществ на скорость реакции в гетерогенной системе
- •Вопросы для самоконтроля
- •Лабораторная работа №2. Приготовление растворов различных концентраций.
- •1. Массовая доля и процентная концентрация.
- •2. Молярная концентрация (см )-
- •3. Молярная концентрация эквивалента (Сн) (нормальность).
- •4. Моляльная концентрация (См) (моляльность).
- •5. Титр раствора (т)
- •Экспериментальная часть. Опыт 1. Приготовление раствора соляной кислоты заданной концентрации.
- •Опыт 2. Определение концентрации кислоты методом титрования.
- •Результаты титрования.
- •Опыт 3. Приготовление раствора соли с заданной массовой долей (%).
- •Результаты опыта приготовления раствора соли
- •Вопросы для самоконтроля.
- •Лабораторная работа № 3 Растворы электролитов.
- •Лабораторная работа №4 Титрование сильной кислоты сильным основанием, слабой кислоты сильным основанием.
- •Экспериментальная часть
- •Построение кривых кислотно-основного титрования
Лабораторная работа №4 Титрование сильной кислоты сильным основанием, слабой кислоты сильным основанием.
Благодаря большому скачку рН на кривой титрования и тому, что точка эквивалентности соответствует рН 7, сильные кислоты можно титровать сильными основания с индикаторами, значение рТ которых лежат как при рН<7, так и при рН>7.
Реактивы:
Соляная кислота, HCl, 0,1М стандартный раствор.
Гидроксид натрия, NaOH, 0,1 М раствор.
Уксусная кислота, CH3COOH, 0,05 М раствор.
Индикаторы: метиловый оранжевый, 0,1% водный раствор; фенолфталеин, 0,1% спиртовой раствор.
Экспериментальная часть
Опыт 1. Титрование с метиловым оранжевым.
В тщательно вымытую бюретку наливают раствор 0,1 М раствора NaOH. Отбирают пипеткой 10 мл раствора соляной кислоты и переносят в коническую колбу для титрования вместимостью 100 мл, добавляют 2 капли метилового оранжевого и титруют раствором NaOH до изменения окраски раствора из розовой в чисто-желтую. Титруют не менее трех раз. Результаты трех титрований не должны отличаться друг от друга более чем на 0,1 мл.
Опыт 2. Титрование с фенолфталеином.
В колбу для титрования помещают пипеткой 20 мл 0,05 М раствора уксусной кислоты, 2-3 капли фенолфталеина и титруют раствором гидроксида натрия до появления бледно- розовой окраски. С помощью индикаторной бумаги определяют рН раствора оттитрованной пробы в точке эквивалентности. Титруют не менее трех раз. Результаты трех титрований не должны отличаться друг от друга более чем на 0,1 мл.
Провести теоретический расчет кривых титрования для первого и второго опыта.
Построение кривых кислотно-основного титрования
Кривая титрования – кривая, выражающая изменение рН титруемого раствора в зависимости от объема прилитого титранта.
Построение кривой – нанести следующие точки:
-
Исходную точку титрования, соответствующую 0 мл титранта
-
Точку эквивалентности
-
Промежуточные точки на кривой, показывающие, как изменяется рН раствора в процессе титрования.

С0, V0 – концентрация, объем титруемого вещества
СТ, VT - концентрация, объем титранта
ΣV=V0+VТ
Ка – константа диссоциации исходной кислоты
КВ - константа диссоциации исходного основания
KW – константа ионного произведения воды 1∙10-14
|
Титрование слабой кислоты сильным основанием
|
Титрование сильной кислоты сильным основанием
|
|
1. Эквивалентный объем сильного основания Vэкв определяют по закону эквивалентов:
|
|
|
2. Объем титранта равен нулю
|
|
3. Объем титранта меньше Vэкв
|
|
4. Объем титранта равен Vэкв
|
4. Объем титранта равен Vэкв
|
|
5. Объем титранта большеVэкв
|
|
|
Титрование слабого основания сильной кислотой
|
Титрование сильного основания сильной кислотой
|
|
1. Эквивалентный объем сильной кислоты Vэкв определяют по закону эквивалентов:
|
|
|
2.Объем титранта равен нулю
|
2. Объем титранта равен нулю
|
|
3.Объем титранта меньше Vэкв
|
3. Объем титранта меньше Vэкв
|
|
4. Объем титранта равен Vэкв
|
4. Объем титранта равен Vэкв
|
|
5. Объем титранта большеVэкв
|
|