
- •Требования по выполнению контрольной работы по органической химии:
- •Выбор варианта контрольной работы:
- •Контрольная работа № 1. Вариант - 1
- •Вариант - 2
- •Вариант - 3
- •Вариант - 4
- •Вариант - 5
- •Вариант - 6
- •Вариант - 7
- •Вариант - 8
- •Вариант - 9
- •Вариант - 10
- •Вариант - 11
- •Вариант - 12
- •Вариант - 13
- •Вариант - 14
- •Вариант - 15
- •Задания для домашней контрольной работы № 2. Вариант № 1.
- •Вариант № 2.
- •Вариант № 3.
- •Вариант № 4.
- •Вариант № 5.
- •Вариант № 6.
- •Вариант № 7.
- •Вариант № 8.
- •Вариант № 9.
- •Вариант № 10.
- •Вариант № 11.
- •Вариант № 12.
- •Вариант № 13.
- •Вариант № 14.
- •Вариант № 15.
- •Методика решения типовых заданий. Тема: Строение атома
- •Реакция с образованием газов
- •Оба реагирующих веществ в водном растворе находятся в виде ионов
- •Реакция с образованием газов
Оба реагирующих веществ в водном растворе находятся в виде ионов
![]() .Образование
осадка сводится к взаимодействию ионов
Ag+
и СL-
, так как образуется малодиссоциирующее
соединение(краткое ионное уравнение)
.Образование
осадка сводится к взаимодействию ионов
Ag+
и СL-
, так как образуется малодиссоциирующее
соединение(краткое ионное уравнение)
A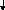 g+
+
CL-
= AgCL
g+
+
CL-
= AgCL
Полное ионное уравнение имеет вид :
N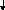 a+
+ C
a+
+ C![]() +
Ag+
+
+
Ag+
+
![]() =
AgCL +Na+
+
=
AgCL +Na+
+
![]()
Реакция с образованием газов
Na2S + 2HCL1 = 2NaCL + H2S
Д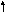 ля
простоты и удобства напишем сразу
уравнение реакции в сокращенной форме:
ля
простоты и удобства напишем сразу
уравнение реакции в сокращенной форме:
2H+
+![]() = H2S
= H2S
е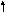 сли
одно из взятых веществ является трудно
растворимым в воде (неэлектролит), то
формула этого вещества записывается в
молекулярной форме:
сли
одно из взятых веществ является трудно
растворимым в воде (неэлектролит), то
формула этого вещества записывается в
молекулярной форме:
C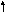 a3P2
+ 6HNO3
= 3Ca(NO3)2
+ 2PH3
a3P2
+ 6HNO3
= 3Ca(NO3)2
+ 2PH3
Ca3P2 + 6H+ = 3Ca2+ + 2PH3
Реакция с образованием слабых электролитов.К слабым электролитам относятся вещества со степенью диссоциации меньше 2%, например вода, слабые кислоты, трудно растворимые основания соли и др.
П ример1.
Ca(HCO3)2
+
2HBr = CaBr2+2H2O
+ 2CO2
ример1.
Ca(HCO3)2
+
2HBr = CaBr2+2H2O
+ 2CO2
HC![]() + H+
= H2O
+ CO2
+ H+
= H2O
+ CO2
Пример2. 2CrOHSO4 +H2SO4 = Cr2(SO4)3 + 2H2O
CrOH2+ + H+ = Cr3+ +H2
Тема :Гидролиз солей
Гидролиз соли — это реакция обмена ионов соли с ионами воды.
При гидролизе смещается равновесие диссоциации воды вследствие связывания одного из ионов в слабый электролит.
При
связывании ионов Н+
в растворе накапливаются ионы
![]() ,
реакция среды будет щелочная, а при
связывании ионов
,
реакция среды будет щелочная, а при
связывании ионов
![]() накапливаются ионы Н+
—
среда кислая.
накапливаются ионы Н+
—
среда кислая.
Разберем случаи гидролиза, пользуясь понятиями «слабый» и «сильный» электролит.
I. Соль образована сильным основанием и сильной кислотой (гидролизу не подвергается). При растворении в воде в присутствии индикатора лакмуса нитрата калия окраска лакмуса не изменяется. Уравнение реакции в молекулярной и ионной формах имеет вид:
KNO3+H2O![]() KOH+HNO3
KOH+HNO3
K=
+N![]() +HOH
+HOH
![]() K+
+O
K+
+O![]() +H+
+N
+H+
+N![]()
Среда нейтральная, так как ионы Н+ и ОН" не связываются другими зонами в слабый электролит.
П.
Соль
образована сильным основанием и слабой
кислотой
(гидролиз
протекает по аниону). Это имеет место
при гидролизе соли
![]() .
При диссоциации ионы соли
.
При диссоциации ионы соли
![]() и
и
![]() взаимодействуют
с ионами Н+
и
взаимодействуют
с ионами Н+
и
![]() из воды. При этом ацетат-ионы (
из воды. При этом ацетат-ионы (![]() )
связываются с ионами водорода (Н+)
в молекулы слабого
электролита — уксусной кислоты (СН3СООН),
а ионы
)
связываются с ионами водорода (Н+)
в молекулы слабого
электролита — уксусной кислоты (СН3СООН),
а ионы
![]() накапливаются
в растворе, сообщая ему щелочную
реакцию,
так
как ионы К+
не могут связать ионы
накапливаются
в растворе, сообщая ему щелочную
реакцию,
так
как ионы К+
не могут связать ионы
![]() (КОН
является
сильным электролитом).
(КОН
является
сильным электролитом).
Уравнения гидролиза соли СН3СООК будут иметь следующий вид:
в молекулярной форме
![]()
в ионной форме
![]()
в сокращенной ионной форме
![]()
Соль
образована слабым основанием и сильной
кислотой
(гидролиз протекает по катиону). Это
имеет место при гидролизе соли NH4C1
(NH4OH
— слабое основание,
НС1
— сильная кислота), Отбросим ион
![]() ,
так как он с катионом воды дает сильный
элей тролит, тогда в сокращенной ионной
форме уравнение гидролиза примет
следующий вид:
,
так как он с катионом воды дает сильный
элей тролит, тогда в сокращенной ионной
форме уравнение гидролиза примет
следующий вид:
![]()
В молекулярной форме:
![]()
Ионы OH- связываются в слабый электролит, а ионы H+ накапливаются – среда кислая.
Соль образована основанием и слабой кислотой(гидролиз протекает по катиону аниону). Это имеет место при гидролизе соли CH3COONH4. Запишем уравнение в ионной форме:
![]()
Образуется слабое основание и слабая кислота. Степень диссоциация которых приблизительно одинакова. Поэтому при наличии гидролиза среда будет приблизительно нейтральная.
тема: Неметаллы
Общая характеристика неметаллов. Число неметаллов, известных в природе, по сравнению с металлами относительно невелико. Их размещение в периодической системе химических элементов Д. И. Менделеева показано в таблице 5.
Из таблицы 5 видно, что элементы - неметаллы в основном расположены в правой верхней части периодической системы химических элементов Д. И. Менделеева. Так как в периодах постепенно увеличиваются заряды ядер атомов элементов и уменьшаются атомные радиусы, а в главных подгруппах с увеличением порядков номера элемента атомные радиусы резко возрастают, то становиться понятным, почему атомы неметаллов сильнее притягивают внешние электроны по сравнению с атомами металлов. Таким образом, у неметаллов преобладают окислительные свойства, т. е. способность присоединять электроны. Особо ярко эти свойства важны у неметаллов VII и VI групп главных подгрупп 2-го и 3-го периодов. Самый сильный окислитель – фтор. Окислительные способности элементов – неметаллов зависят от численного значения электроотрицательности и увеличиваются в следующем порядке:
Si, B, H, P, C, S, I, N, Cl, O, F

Такая же закономерность в изменении окислительных свойств характерна для соответствующих простых веществ. Ее можно наблюдать в реакциях указанных неметаллов с водородом и металлами. Так, фтор более энергично реагирует с водородом и металлами:
![]()
Кислород реагирует менее энергично:
![]()
Фор как самый активный неметалл в химических реакциях вообще не проявляет восстановительных свойств, т. е. фтор не способен отдавать электроны.
Кислород
же в соединение с фтором (![]()
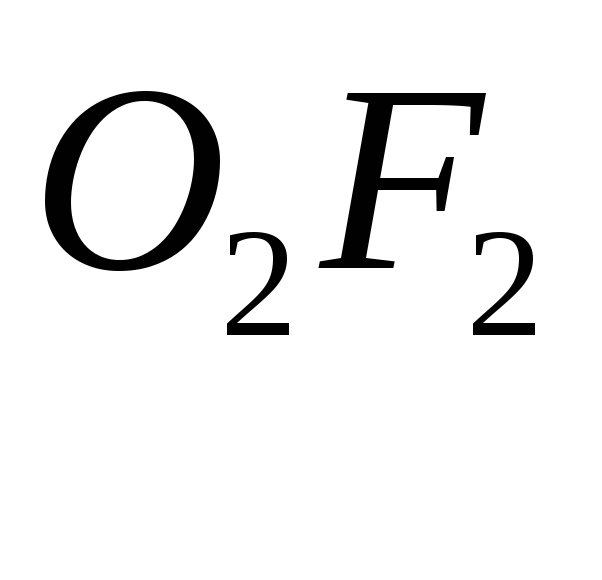 )
проявляет положительную степень
окисления, т. е. может быть восстановителем.
)
проявляет положительную степень
окисления, т. е. может быть восстановителем.
Восстановительные свойства, хотя и в значительно более слабой степени по сравнению с металлами, проявляют и все остальные элементы – неметаллы и соответствующие им простые вещества, причем эти свойства постепенно возрастают от кислорода к кремнию:
O ,
Cl, N, I, S, C, P, H, B, Si
,
Cl, N, I, S, C, P, H, B, Si
Например,
хлор непосредственно с кислородом не
соединяется, но косвенным путем можно
получить оксид хлора
![]() ,
в которых хлор проявляет положительную
степень окисления. Азот, как вам известно
(II),
при высокой температуре непосредственно
соединяется с кислородом и проявляет
при этом восстановительные свойства:
,
в которых хлор проявляет положительную
степень окисления. Азот, как вам известно
(II),
при высокой температуре непосредственно
соединяется с кислородом и проявляет
при этом восстановительные свойства:
![]()
![]()
![]()
Еще энергичнее с кислородом реагирует сера:
![]()
причем сера примерно в равной степени проявляет как восстановительные, так и окислительные свойства. Так, при нагревании паров серы с водородом происходит реакция:
![]()
Тема :Металлы.
Чистые металлы в твердом состоянии — это кристаллы, в которых частицы вещества расположены в определенном геометрическом порядке, образуя кристаллическую решетку, в узлах которой находятся положительно заряженные ионы и нейтральные атомы, а между ними перемещаются свободные электроны.
Атомы в кристаллической решетке металлов расположены очень близко друг к другу и их внешние электроны могут перемещаться не только вокруг одного атома, а вокруг многих. Таким образом, внешние электроны свободно перемещаются по всему металлу» образуя так называемый «электронный газ».
Существование свободных электронов в металлах подтверждается тем, что металлы обладают большой электрической проводимостью, при нагревании все металлы испускают поток свободных электронов.
Все металлы, за исключением ртути, при обычных условиях, твердые вещества. В компактном состоянии (в виде пластинки, слитка) для металлов характерен металлический блеск из-за отражения света от их поверхности. В тонкоизмельченном состоянии металлический блеск сохраняют только магний и алюминий, порошки остальных металлов черного или темно-серого цвета.
Большинство металлов имеют белый серебристый цвет, не прозрачны (так как почти все они в одинаковой мере поглощают лучи длинных и коротких волн света). Цезий и золото — желтого цвета, медь — желто-красного.
В технике металлы принято делить на группы:
по цвету — черные (железо, хром, марганец и их сплавы); цветные — все остальные;
по плотности — легкие — плотность меньше 5 г/см8 (литий, калий, кальций, алюминий и др.); тяжелые — плотность больше 5 г/см3 (олово, свинец, ртуть, железо и др.). Самым легким металлом является литий (пл. 0,53), самым тяжелым — осмий (пл. 22,5);
по температуре плавления — легкоплавкие — т. пл. 350. °С и ниже (свинец 327 °С, олово 232 °С, натрий 98 °С, калий 63 °С, цезий 28 °С и др.); тугоплавкие — т. пл. выше 350 °С (железо 1539 °С, хром 1875 °С). Самый тугоплавкий металл вольфрам, т. пл. 3380 °С. 4
Важными физическими свойствами металлов являются электрическая проводимость и теплопроводность, которые обусловлены наличием во всех металлах свободных электронов.
Наибольшую электрическую проводимость имеет серебро, затем медь, золото, хром, алюминий, магний.
Из механических свойств для металлов характерны пластичность, ковкость, тягучесть:
пластичность — это свойство металлов деформироваться без трещин, под действием определенной нагрузки;
ковкость — это свойство металлов деформироваться без трещин под влиянием сжатия при температуре ниже температуры плавления металла;
тягучесть—способность металлов вытягиваться в нить.
Металлы с малой тягучестью хрупки, а металлы с большой тягучестью устойчивы на разрыв.
Наибольшей пластичностью, ковкостью и тягучестью обладает золото: из него можно изготовить пластинки толщиной 0,003 мм и вытягивать в проволоку, невидимую невооруженным глазом. В наименьшей степени этими качествами обладают висмут и марганец.
Общим, присущим исключительно металлам, химическим свойством является способность только отдавать электроны, превращаясь в свободные, положительно заряженные ионы:
![]()
Способность отдавать электроны выражена у металлов по-разному. Мерой прочности связи электронов в атомах является энергия ионизации. Наименьшей энергией ионизации обладают щелочные металлы, поэтому они являются энергичными восстановителями.
Восстановительными свойствами металлов обусловлена их способность вступать в реакции с различными окислителями: неметаллами, кислотами, солями менее активных металлов.
Названия всех соединений металлов с неметаллами оканчиваются на -ид (оксид, хлорид, нитрид, сульфид и т. д.).
1. Металлы взаимодействуют с неметаллами:
а) большинство металлов хорошо реагируют с кислородом, давая оксиды:
![]()
б) легко соединяются с галогенами, образуя галогениды:
2Fe + 3Cl2 = 2FeCl3
в) с азотом металлы образуют нитриды:
![]()
г ) при определенных условиях металлы взаимодействуют с серой, образуя сульфиды:
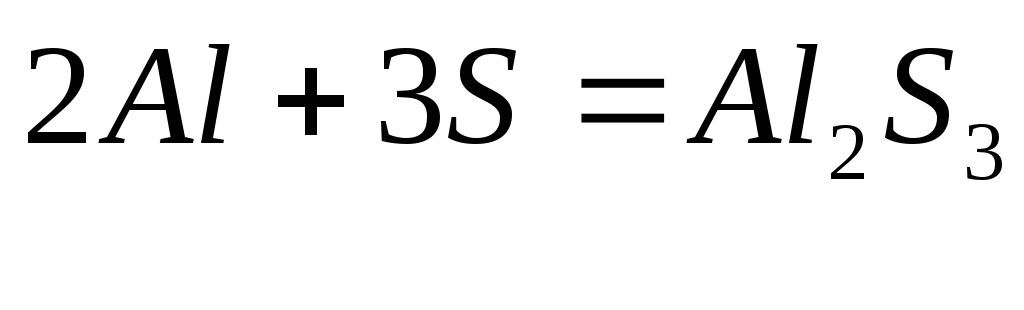
д ) с водородом взаимодействуют непосредственно только щелочные и щелочно-земельные металлы, образуя гидриды:
![]()
П
![]()
Усиление
окислительных свойств
![]()

![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
В этот ряд помещен и водород, потому что это единственный неметалл, разделяющий с металлами их общее свойство — находиться в водных растворах в виде положительных ионов (хотя и гидратированных).
Металлы в ряду стандартных электродных потенциалов расположены по убыванию (ослаблению) их восстановительной способности в растворах или по возрастанию (усилению) окислительной способности их ионов в растворах. В этом ряду каждый предыдущий металл вытесняет из растворов солей все последующие.
Металлы, расположенные в ряду до водорода, вытесняют его из разбавленных кислот (кроме азотной). А щелочные и щелочноземельные — вытесняют водород даже из воды.
Ряд стандартных электродных потенциалов справедлив для окислительно-восстановительных процессов, происходящих только в водной среде.
2. Важные химические свойства металлов проявляются в их отношении к воде, растворам кислот, щелочам, солям.
Щелочные и щелочно-земельные металлы растворяются в воде с образованием гидроксилов (щелочи):
С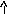 а
+ 2Н2О
а
+ 2Н2О
![]() Са(ОН)2
+ H2
Са(ОН)2
+ H2
Некоторые тяжелые металлы взаимодействуют с водой при нагревании с образованием оксида:
![]()
При рассмотрении химического взаимодействия металлов с кислотами необходимо учитывать концентрацию кислот и активность металла (см. ряд стандартных электродных потенциалов).
![]()
![]()
![]()
Щелочи взаимодействуют только с металлами, проявляющими амфотерные свойства:
![]()

Более активные металлы вытесняют менее активные из растворов их солей:
![]()
