
- •Буферные системы
- •Фиксатор Карнуа
- •Водные фиксирующие смеси Фиксатор Навашина
- •I. Силы, обусловливающие взаимодействие между реактивом и препаратом.
- •3.1.1. Химические фрагменты
- •3.1.2. Специфические вещества
- •3.1.3. Классы веществ
- •3.2. Выявление биологических объектов
- •3.2.1. Биологические объекты
- •2. Антитела
- •2.1. Структура иммуноглобулинов
- •2.2. Поликлоналыная антисыворотка
- •2.3. Моноклональные антитела
- •2.4. Очистка антител
- •2.5. Специфичность реакций антител
- •3. Воздействие на антигены процедуры обработки ткани
- •3.1. Выбор условий обработки ткани
- •4.2. Ферментные метки
- •4.3. Коллоидное золото
- •4.4. Выбор метки
- •5. Методы окраски
- •5.1. Прямой метод.
- •5.2. Непрямой метод
- •5.3. Методы, основанные на взаимодействии фермент—антифермент
- •5.4. Системы с использованием биотин — авидина
- •7. Решение возникающих проблем с помощью контрольных препаратов
- •Глава 4
- •Флуорохромы
- •3. Флуоресцентный микроскоп
- •3.1. Способы освещения
- •3.1.1. Освещение проходящим светом
- •3.1.2. Освещение падающим светом
- •3.2. Источники света
- •3.3. Домики для ламп
- •3.4. Фильтры
- •3.4.1. Возбуждающие фильтры
- •3.4.2. Запирающие фильтры
- •3.4.3. Цветные светоделительные зеркала
- •3.5. Объективы и окуляры
- •4. Применение флуоресцентных красителей
- •4.1. Нуклеиновые кислоты
- •4.1.1. Прижизненное окрашивание флуорохромами
- •4.2. Иммунофлуоресценция
- •7. Сканирующая лазерная микроскопия
5.4. Системы с использованием биотин — авидина
Авидин — белок, экстрагируемый из яичного белка, — содержит четыре участка связывания, обладающих высоким сродством к биотину из печени. Биотин можно ковалентно связать с первичными или вторичными антителами, которые затем выявляют, используя меченый авидин (рис. 4.6). Авидин имеет изоэлектрическую точку при рН, близком к 10, и положительно заряжен в нейтральных буферах. Поэтому в ткани он должен предпочтительно связываться с отрицательно заряженными молекулами. Стрептавидин, выделенный из Streptomyces avidinii, также содержит четыре участка связывания с биотином, но его изоэлектрическая точка близка к 7.
Для мечения фермента лучше не прямо соединять белок с авидином или стрептавидином, а связать его с биотином и использовать немеченый авидин в качестве мостика. Для увеличения чувствительности эта система может использоваться способом, аналогичным методу фермент—антифермент. Вместо меченого авидина наносится комплекс биотинированный фермент—авидин — так называемый ABC-метод (комплекс авидина со связанной с биотином пероксидазой). Показано, что этим способом можно получить комплекс больших размеров, чем тот, который получается при использовании метода фермент—антифермент, т. е. достигнуть большей чувствительности.
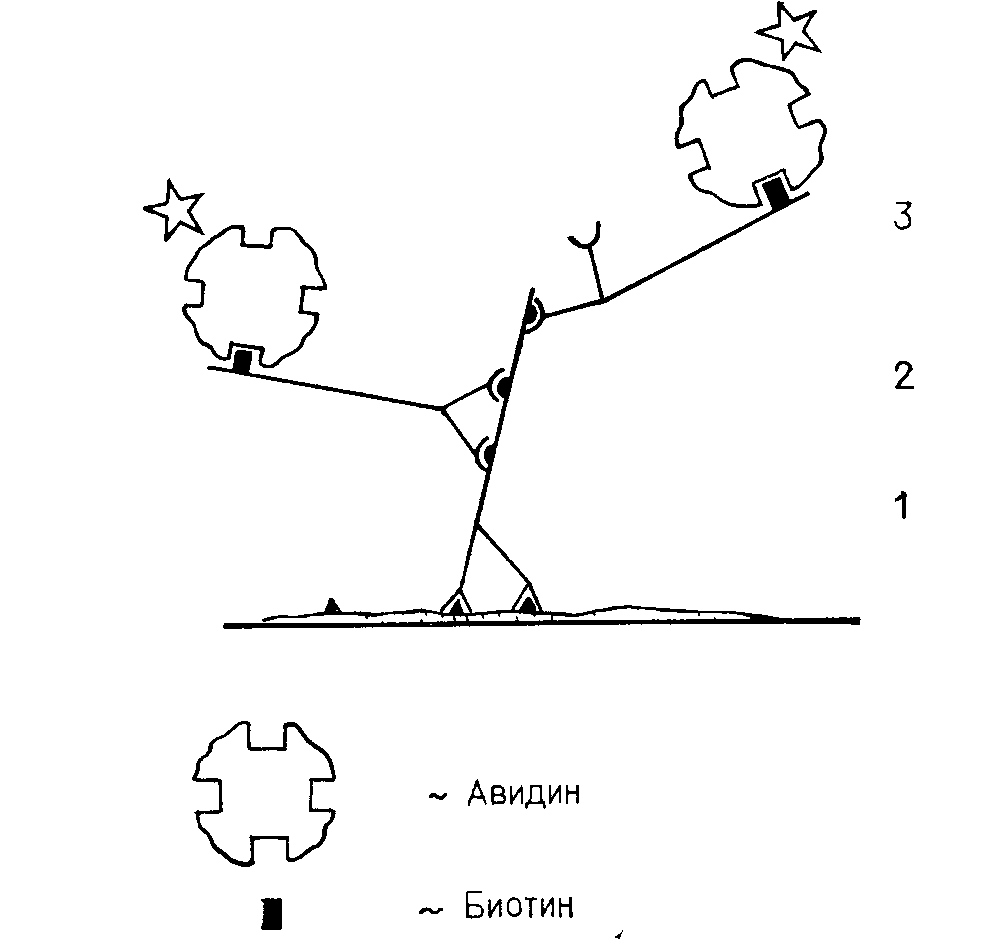
Рис. 4.6. Биотин—авидиновый метод.
1 — первое антитело;
2 — биотинированное второе антитело;
3 — меченый авидин.
При использовании авидина или стрептавидина для работы на срезах печени необходимо соблюдать осторожность, учитывая наличие эндогенного биотина в этой ткани.
Описанный выше метод может использоваться в различных комбинациях. Для повышения чувствительности антитела должны быть связаны с другими антителами. Однако, за исключением особых случаев, это не всегда необходимо и часто нежелательно. В том случае, когда антиген явно разрушен при фиксации ткани, его присутствие может быть обнаружено с помощью высокочувствительного метода. Но и тогда повышенная чувствительность будет приводить к появлению слабых перекрестных реакций и усилению неспецифического окрашивания. В любом случае, если только это возможно, предпочтительнее правильно выбирать условия обработки ткани.
7. Решение возникающих проблем с помощью контрольных препаратов
При проведении гистохимических и иммуногистохимических реакций возникают два типа проблем: с одной стороны, появление нежелательной окраски и, с другой стороны — неожиданное отсутствие окраски. Эти проблемы решаются путем постановки соответствующих контролей.
7.1. Контрольные препараты
Необходимо делать контрольные препараты двух видов — положительный и отрицательный контроли. При использовании каждого антитела необходимо выбрать блок ткани, заведомо содержащий данный антиген, и сделать с него большое количество срезов. Один из них будет использоваться в каждой окраске для того, чтобы по нему определять интенсивность реакции окрашивания.
При каждой окраске в числе препаратов должен также быть препарат исследуемой ткани, на который при постановке реакции не были нанесены первые антитела. Это нужно для проверки на неспецифическое окрашивание, которое могут давать реагенты, используемые для выявления первых антител. Если применяется прямой метод окраски, то данный контроль можно пропустить. При ферментативном методе выявления антител в качестве контроля применяется препарат, на котором для проверки активности эндогенных ферментов ставится только сама цветная реакция.
Вышеуказанные контроли, хотя и являются необходимыми, не позволяют выявить неспецифическое связывание первых антител. При использовании поликлональных антител для этого можно взять их аликвоту и истощить антитела исходным антигеном. Это позволяет уменьшить специфическое окрашивание и обнаружить неспецифическое окрашивание, однако не позволяет выявить эпитопы Данный контроль не обязательно ставить при каждом окрашивании, но если антиген легко доступен, то контроль надо поставить на одном-двух препаратах при первом использовании новой антисыворотки. Применительно к моно-клональным антителам этот тип контроля не имеет смысла. Тестовый препарат может служить контролем сам по себе. Распределение антигена в нем скорее всего известно: например, антитела к Т-лимфоцитам не будут окрашивать эпителиальные клетки. Нужные структуры в нем будут хорошо окрашены, а все остальные останутся прозрачными. Если у вас окрасились «неправильные» клетки, то это дает основание подозревать наличие неспецифического связывания. В частности, «грязный» фон на препарате при недостаточной отмывке дают мышечные клетки стромы.
7.2. Решение проблем
При решении возникающих проблем нужно исходить из простой логики. Описанные выше контроли должны указывать на то, в какой части процедуры присутствует ошибка. Вам^ в свою очередь следует тщательно проверить каждый шаг. Часто ис-
точником трудностей является какая-нибудь мелочь. Желательно, например, использовать предметные стекла, матированные с одной стороны, и четко помечать их карандашом. Без этого бывает иногда трудно отличить одну поверхность предметного
[стекла от другой, и таким образом, можно окрасить не ту сто-
• рону.
I Существует три типа неправильного окрашивания: недостаточное, избыточное и неспецифическое окрашивание. Полное отсутствие окраски на положительном контрольном препарате часто указывает на то, что был случайно пропущен реактив или было взято не то вещество. Если окрашивали одновременно много срезов с использованием различных антител, то, вероятно, ошибка относится ко второму антителу, которое использовали в данной окраске (например, взяли антикроличьи антитела при окраске срезов мышиными антителами).
Слабая окраска указывает на то, что один из наиболее лабильных реактивов был испорченным. Например, при использовании окрашивания пероксидазой необходим свежий раствор Н2О2. Для предотвращения роста бактерий в буферных растворах к ним часто добавляют азид натрия. Азид ингибирует многие ферменты, так что использование буфера с азидом может вызвать трудности при проведении реакции с хромогеном.
Избыточное окрашивание часто является следствием ошибки в разведении одного из реактивов. Проблемы могут возникать также из-за температуры. Большинство исследований проводятся обычно при комнатной температуре, которая в помещениях, где нет кондиционера, может различаться на 10 °С. Скорость ферментативных реакций резко возрастает с увеличением температуры, так что методика окрашивания, разработанная в холодный день, может привести к образованию избыточного цветного продукта в жаркую погоду.
Если объем раствора антител недостаточен для того, чтобы как следует покрыть срезы, то следует помнить, что любое испарение во время инкубации приведет к повышению концентрации антител в срезе, что приведет к избыточному окрашиванию. В предельном случае, если раствор на части срезов полностью высох, появится интенсивное фоновое окрашивание.
Избыточное окрашивание приводит к усилению неспецифического окрашивания. Кроме того, если данная проблема возникает постоянно, то следует обратить особое внимание на процедуры, связанные с отмывкой препаратов, в частности на возможное присутствие белка в буфере. Если трудности возникают на стадии применения первых антител, то можно попробовать предварительно инкубировать срезы в течение 15 мин в растворе ФСБ, содержащем 5% сыворотки от другого вида животного
184
