
- •Лекция 1 Введение
- •Физика Предмет физики
- •Лекция 2 Механика
- •Кинематика материальной точки
- •Динамика.
- •Динамика материальной точки.
- •Первый закон Ньютона. Инерциальные системы отсчёта (исо). Принцип относительности. Преобразования Галилея.
- •Импульс частицы (количество движения)
- •Второй закон Ньютона. Понятие силы. Масса – мера инертности. Определение силы.
- •Закон независимости действия сил (принцип суперпозиции сил). Равнодействующая сил.
- •Интегральное выражение основного закона динамики. Понятие импульса силы.
- •Третий закон Ньютона.
- •Динамика систем материальных точек. Обобщение II закона Ньютона для системы материальных точек. Импульс системы. Закон сохранения импульса системы.
- •Центр инерции системы частиц (тела). Закон аддитивности массы.
- •Интегральное выражение основного закона динамики системы частиц. Закон сохранения проекции импульса системы.
- •Классификация сил. Фундаментальные воздействия. Законы эмпирических сил.
- •Закон всемирного тяготения.
- •Однородное поле тяжести Земли.
- •Понятие веса тела.
- •Упругие деформации. Закон Гука.
- •Силы трения.
- •Сухое трение.
- •Трение покоя.
- •Трение скольжения.
- •Трение качения.
- •Вязкое трение.
- •Сила сопротивления.
- •Сила Архимеда.
- •Реактивная сила.
- •Механическая энергия и её виды. Закон сохранения механической энергии.
- •Консервативные и неконсервативные силы.
- •Закон сохранения механической энергии.
- •Потенциальная энергия упругих взаимодействий.
- •Потенциальная энергия тяготения.
- •Теорема о потенциальной энергии. Связь между консервативной силой и потенциальной энергией.
- •Потенциальные кривые.
- •Основной закон динамики вращательного движения. Закон сохранения момента импульса системы частиц (тела).
- •Динамика материальной точки
- •Динамика системы материальных точек
- •Динамика вращательного движения тела относительно неподвижной оси.
- •Элементы динамики твёрдого тела.
- •Закон сохранения момента импульса относительно оси.
- •Кинетическая энергия вращения твёрдого тела.
- •Плоское движение твёрдого тела.
- •Теорема Штейнера.
- •Работа момента силы относительно оси.
- •Заключение.
- •Основы молекулярной физики и термодинамики. Введение
- •Элементы молекулярно-кинетической теории. Основные представления и понятия.
- •Модель идеального газа. Уравнение состояния идеального газа.
- •Основное уравнение молекулярно-кинетической теории идеального газа.
- •Температура
- •Тепловая скорость молекул газа.
- •Вывод уравнения состояния идеального газа.
- •Барометрическая формула. Закон Больцмана.
- •Закон равномерного распределения энергии по степеням свободы молекул газа.
- •Внутренняя энергия идеального газа.
- •Распределение молекул по скоростям (закон Максвелла).
- •Распределение по кинетическим энергиям поступательного движения молекул газа.
- •Явление переноса
- •Явление теплопроводности. Закон Фурье.
- •Явление диффузии. Закон Фика
- •Вязкое трение. Закон ньютона.
- •Явление переноса в газах.
- •Средняя частота столкновений и средняя длина свободного пробега молекул газа.
- •Диффузия в газах.
- •Теплопроводность газов.
- •Вязкость газов.
- •Внутренняя энергия термодинамической системы. Работа и теплота как обобщённые формы обмена энергией в термодинамике.
- •Первое начало термодинамики.
- •Равновесные процессы.
- •Применение первого начала термодинамики к равновесным процессам с идеальным газом. Изотермический процесс.
- •Изохорный процесс.
- •Изобарный процесс.
- •Адиабатный процесс.
- •Политропный процесс.
- •Круговые процессы. Цикл Карно. Кпд тепловых машин.
- •Второе начало термодинамики.
- •Теорема Карно и Клаузиуса.
- •Энтропия.
- •Основное уравнение термодинамики обратимых процессов.
- •Примеры расчёта энтропии для обратимых процессов. Энтропия идеального газа.
- •Изменение энтропии при обратимом нагреве (охлаждении) жидких и твёрдых тел.
- •Изменение энтропии при фазовых превращениях.
- •Подведём итоги об энтропии и её свойствах.
- •Примеры роста энтропии в изолированных системах.
- •Расширение идеального газа в пустоту.
- •Формула Больцмана. Статистический смысл энтропии.
Энтропия.
Рассмотрим равновесный круговой процесс (см. рисунок) 1а2в1. запишем теорему Клаузиуса для этого процесса:
![]()
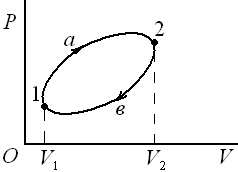 .
.
Перенесём одно из слагаемых в правую часть равенства и изменим у него направление интегрирования на противоположное, что изменит знак у интеграла. Тогда получим равенство следующего вида:
![]() .
.
Это равенство показывает, что приведённое
тепло, взятое по обратимому процессу,
не зависит от промежуточных состояний
процесса, а зависит только от его
начального и конечного состояний. Это
свойство приведённого тепла означает,
что его в обратимом процессе можно
рассматривать как изменение некоторой
функции состояния. Эта функция
состояния называется энтропией и
обозначается буквой
![]() .
Итак, по определению:
.
Итак, по определению:
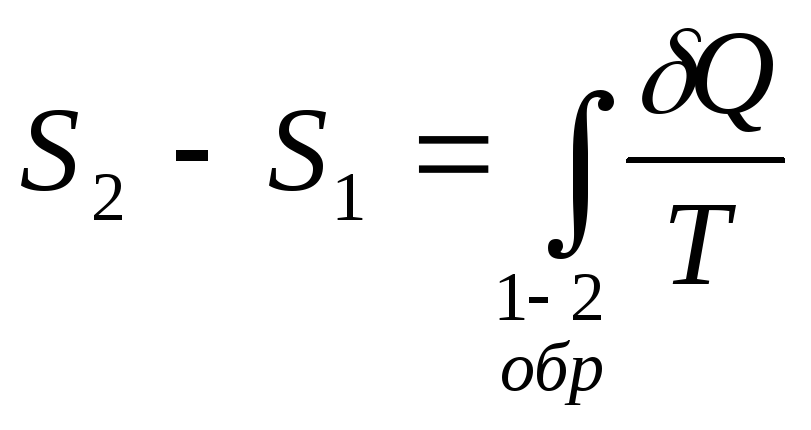 ,
,
![]() .
.
Энтропией называется функция состояния термодинамической системы, изменение которой равно приведённому теплу, взятому по обратимому процессу, соединяющему рассматриваемые состояния. В этом определении говорится лишь об изменении энтропии. Чтобы определить абсолютное значение энтропии нужен дополнительный постулат. Это теорема Нернста: при приближении к нулю абсолютной температуры энтропия любого тела стремится к нулю.
Отметим, что данное определение энтропии является сугубо формальным. Энтропию нельзя измерить. Изменение энтропии можно вычислить. Для этого два состояния соединяют подходящим равновесным процессом и производят вычисления.
Некоторую наглядность и физический смысл энтропия получает в рамках статистической физики.
Теперь обратимся к следствию из теоремы Клаудиуса для необратимого кругового процесса:
![]() .
.
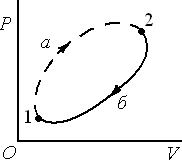 Рассмотрим
круговой процесс, состоящий из необратимого
участка 1а2 и обратимого участка 2б1 (см.
диаграмму).
Рассмотрим
круговой процесс, состоящий из необратимого
участка 1а2 и обратимого участка 2б1 (см.
диаграмму).
Представим приведённую теплоту кругового процесса как сумму:
![]() .
.
Перенесём второе слагаемое в правую часть и изменим направление интегрирования, так процесс 2б1 является обратимым:
![]() .
.
Следовательно,
![]() .
.
Изменение энтропии равно приведённому теплу при обратимом процессе, но больше приведённого тепла при необратимом процессе. В общем случае можно записать:
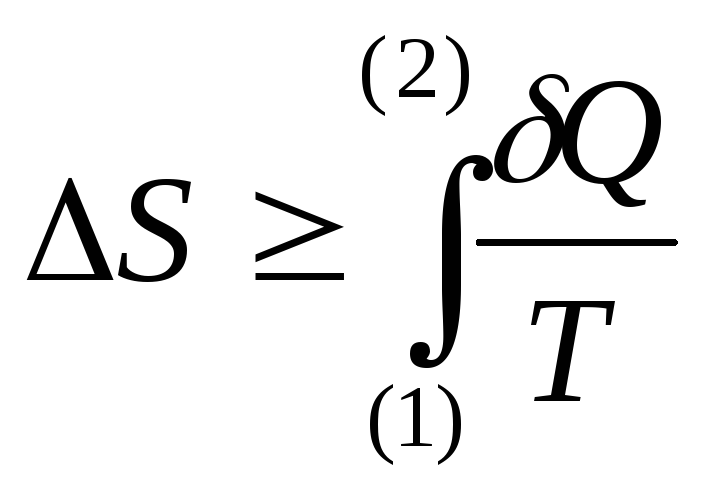 ,
,
![]() ,
,
где знак «=» относится к обратимому процессу, а знак «>» - к необратимому.
Для адиабатической системы
![]() и, следовательно,
и, следовательно,
![]() или
или
![]() .
.
Мы получили важное следствие: в адиабатических системах энтропия в обратимых процессах остаётся постоянной, а в необратимых возрастает. Но, поскольку обратимых процессов в природе не существует, то можно сделать заключение, что во всех реальных адиабатных процессах энтропия обязательно возрастает. Это утверждение называется законом роста энтропии и является наиболее общей формулировкой II н.т.д. для изолированных т.д.с.
Этот закон до некоторой степени
приоткрывает физический смысл понятия
энтропии. Одностороннее изменение
энтропии связано с необратимостью
процессов в адиабатических системах.
Энтропия есть величина, обусловленная
необратимостью термодинамических
процессов: то, что вызывает необратимость,
ведёт к существованию энтропии и её
росту. Это процессы релаксации. В процессе
релаксации макросистема переходит от
менее вероятных состояний к более
вероятным. Отметим, что энтропия является
величиной аддитивной: энтропия тела
равна сумме энтропий его частей:
![]() .
Это связано с аддитивностью количества
тепла, а температура в равновесии для
всех частей тела одинакова.
.
Это связано с аддитивностью количества
тепла, а температура в равновесии для
всех частей тела одинакова.
Кроме того, энтропия является однозначной и монотонной функцией внутренней энергии. Выразим:
![]() .
.
При
![]() :
:
![]() .
.
Так как
![]() и положительная величина
и положительная величина
![]() ,
то, следовательно,
,
то, следовательно,
![]() ,
т.е.
,
т.е.
![]() .
.
