
- •Лекция 1 Введение
- •Физика Предмет физики
- •Лекция 2 Механика
- •Кинематика материальной точки
- •Динамика.
- •Динамика материальной точки.
- •Первый закон Ньютона. Инерциальные системы отсчёта (исо). Принцип относительности. Преобразования Галилея.
- •Импульс частицы (количество движения)
- •Второй закон Ньютона. Понятие силы. Масса – мера инертности. Определение силы.
- •Закон независимости действия сил (принцип суперпозиции сил). Равнодействующая сил.
- •Интегральное выражение основного закона динамики. Понятие импульса силы.
- •Третий закон Ньютона.
- •Динамика систем материальных точек. Обобщение II закона Ньютона для системы материальных точек. Импульс системы. Закон сохранения импульса системы.
- •Центр инерции системы частиц (тела). Закон аддитивности массы.
- •Интегральное выражение основного закона динамики системы частиц. Закон сохранения проекции импульса системы.
- •Классификация сил. Фундаментальные воздействия. Законы эмпирических сил.
- •Закон всемирного тяготения.
- •Однородное поле тяжести Земли.
- •Понятие веса тела.
- •Упругие деформации. Закон Гука.
- •Силы трения.
- •Сухое трение.
- •Трение покоя.
- •Трение скольжения.
- •Трение качения.
- •Вязкое трение.
- •Сила сопротивления.
- •Сила Архимеда.
- •Реактивная сила.
- •Механическая энергия и её виды. Закон сохранения механической энергии.
- •Консервативные и неконсервативные силы.
- •Закон сохранения механической энергии.
- •Потенциальная энергия упругих взаимодействий.
- •Потенциальная энергия тяготения.
- •Теорема о потенциальной энергии. Связь между консервативной силой и потенциальной энергией.
- •Потенциальные кривые.
- •Основной закон динамики вращательного движения. Закон сохранения момента импульса системы частиц (тела).
- •Динамика материальной точки
- •Динамика системы материальных точек
- •Динамика вращательного движения тела относительно неподвижной оси.
- •Элементы динамики твёрдого тела.
- •Закон сохранения момента импульса относительно оси.
- •Кинетическая энергия вращения твёрдого тела.
- •Плоское движение твёрдого тела.
- •Теорема Штейнера.
- •Работа момента силы относительно оси.
- •Заключение.
- •Основы молекулярной физики и термодинамики. Введение
- •Элементы молекулярно-кинетической теории. Основные представления и понятия.
- •Модель идеального газа. Уравнение состояния идеального газа.
- •Основное уравнение молекулярно-кинетической теории идеального газа.
- •Температура
- •Тепловая скорость молекул газа.
- •Вывод уравнения состояния идеального газа.
- •Барометрическая формула. Закон Больцмана.
- •Закон равномерного распределения энергии по степеням свободы молекул газа.
- •Внутренняя энергия идеального газа.
- •Распределение молекул по скоростям (закон Максвелла).
- •Распределение по кинетическим энергиям поступательного движения молекул газа.
- •Явление переноса
- •Явление теплопроводности. Закон Фурье.
- •Явление диффузии. Закон Фика
- •Вязкое трение. Закон ньютона.
- •Явление переноса в газах.
- •Средняя частота столкновений и средняя длина свободного пробега молекул газа.
- •Диффузия в газах.
- •Теплопроводность газов.
- •Вязкость газов.
- •Внутренняя энергия термодинамической системы. Работа и теплота как обобщённые формы обмена энергией в термодинамике.
- •Первое начало термодинамики.
- •Равновесные процессы.
- •Применение первого начала термодинамики к равновесным процессам с идеальным газом. Изотермический процесс.
- •Изохорный процесс.
- •Изобарный процесс.
- •Адиабатный процесс.
- •Политропный процесс.
- •Круговые процессы. Цикл Карно. Кпд тепловых машин.
- •Второе начало термодинамики.
- •Теорема Карно и Клаузиуса.
- •Энтропия.
- •Основное уравнение термодинамики обратимых процессов.
- •Примеры расчёта энтропии для обратимых процессов. Энтропия идеального газа.
- •Изменение энтропии при обратимом нагреве (охлаждении) жидких и твёрдых тел.
- •Изменение энтропии при фазовых превращениях.
- •Подведём итоги об энтропии и её свойствах.
- •Примеры роста энтропии в изолированных системах.
- •Расширение идеального газа в пустоту.
- •Формула Больцмана. Статистический смысл энтропии.
Температура
Понятие «температура» занимает центральное место в учении о тепловых процессах. Оно является довольно сложным, и длительное время уточнялось по мере развития термодинамики и статистической физики. Например, понятие температуры как «степени нагретости» тела имеет явно выраженный субъективный аспект. Объективная возможность введения понятия температуры связана со свойствами теплового равновесия. Состояния теплового равновесия отличаются друг от друга. Мерой теплового равновесия является температура.
Температура как мера теплового равновесия обладает следующими свойствами:
-
если ТДС (тела) А и В не находятся в состоянии теплового равновесия и при тепловом контакте наблюдается переход энергии от А к В, то
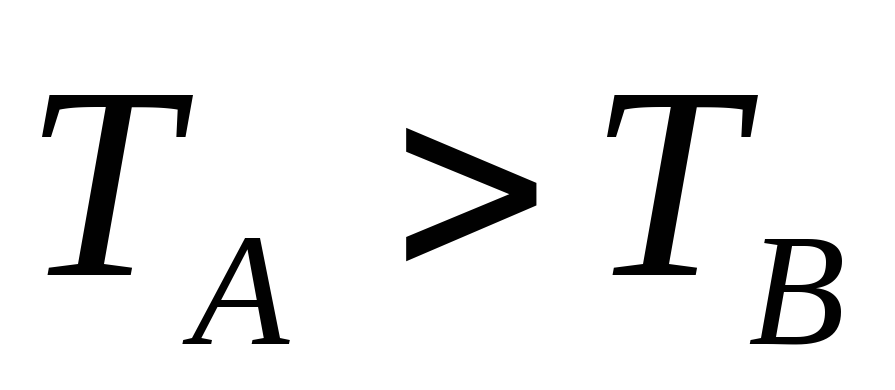 .
.
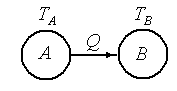
-
если совместная система (А+В) является изолированной, то с течением времени наступит новое состояние равновесия с температурой
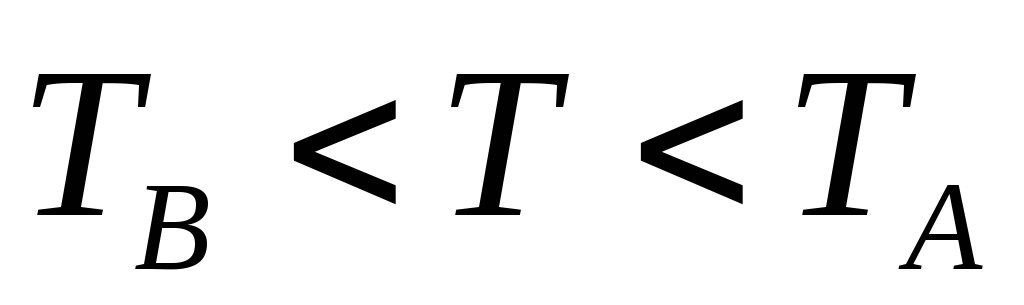 .
. -
если при тепловом контакте тел А и В не наблюдается перехода энергии (Q=0), то А и В находятся в одинаковом состоянии теплового равновесия (
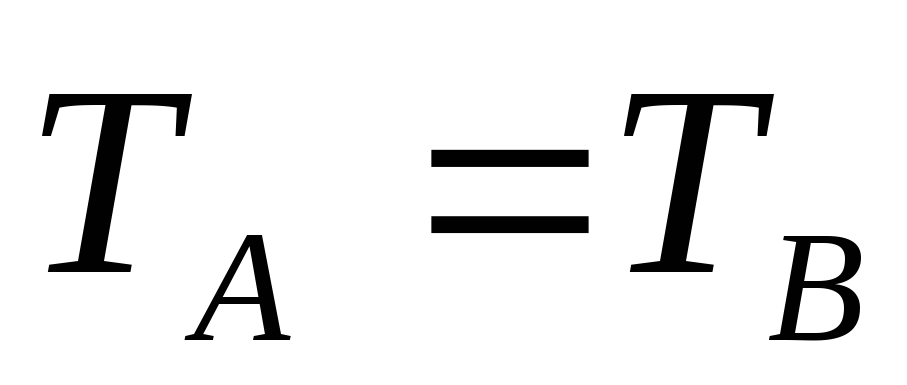 ).
Если при тепловом контакте В и С Q=0,
то
).
Если при тепловом контакте В и С Q=0,
то
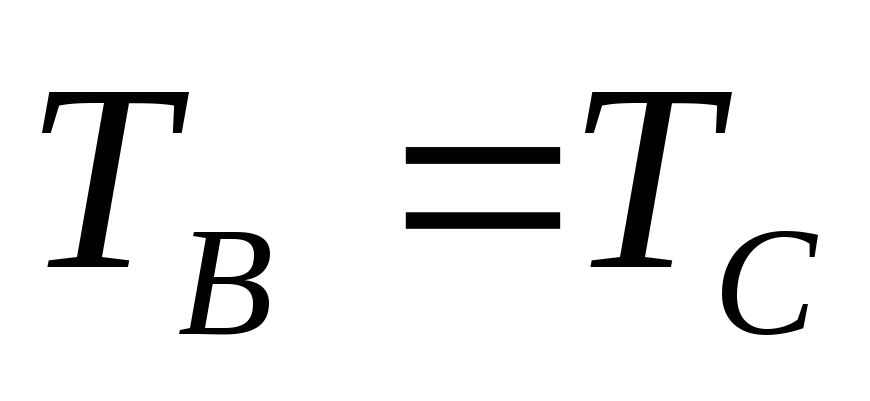 ,
т.е.
,
т.е.
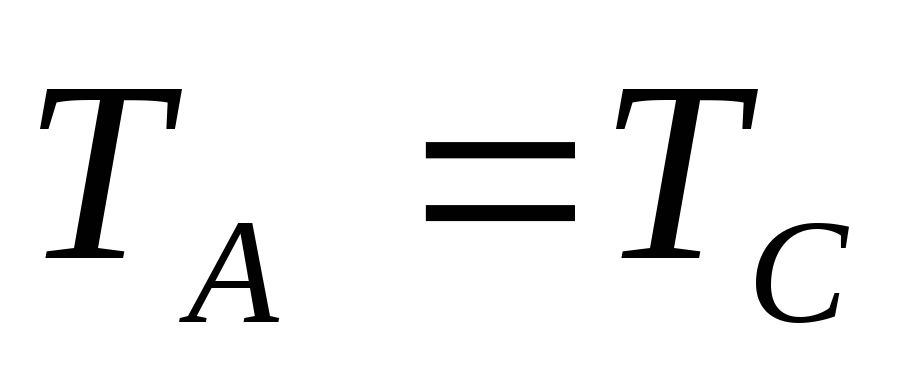 .Тепловое
равновесие обладает свойством
транзитивности.
.Тепловое
равновесие обладает свойством
транзитивности.
Тепловое равновесие не зависит от объёма, давления, плотности и других величин, определяющих состояние системы. Оно однозначно определяется температурой, которая относится к числу внутренних параметров системы, является макроскопической характеристикой системы в целом и для отдельной молекулы смысла не имеет.
В отличие от многих других физических величин температура не может быть измерена непосредственно. Измерение температуры производится косвенными методами, основанными на физических свойствах тел, которые могут быть измерены непосредственно. Тело, выбираемое для измерения температуры, называется термометрическим, а физическая величина, используемая для измерения температуры – термометрическоё величиной. Например, в медицинском термометре термометрическим телом является ртуть, а термометрической величиной – объём столба ртути. Увеличение объёма термометрического тела при нагревании даёт косвенную информацию об изменении температуры.
Если зависимость объёма тела (газа) от температуры линейная, то достаточно выбрать две реперные точки, приписать этим точкам определённые значения температуры, а полученный интервал разделить на некоторое число промежутков. По такому принципу строится любая эмпирическая шкала температуры (Цельсия, Реомюра, Фаренгейта).
Очевидно, подобные температурные шкалы
являются условными. Например,
современный вариант шкалы Цельсия
строится на двух реперных точках:
температура таяния льда
![]() и кипения воды
и кипения воды
![]() при нормальном давлении. При использовании
различных термометрических тел точные
значения температура имеет только для
реперных точек, для промежуточных точек
наблюдается расхождение. Наиболее
точными являются газовые термометры,
использующие достаточно разрежённый
(идеальной) газ.
при нормальном давлении. При использовании
различных термометрических тел точные
значения температура имеет только для
реперных точек, для промежуточных точек
наблюдается расхождение. Наиболее
точными являются газовые термометры,
использующие достаточно разрежённый
(идеальной) газ.
Средняя кинетическая энергия
поступательного движения молекул газа
обладает всеми свойствами температуры.
Поэтому в качестве температуры можно
использовать величину пропорциональную
средней энергии
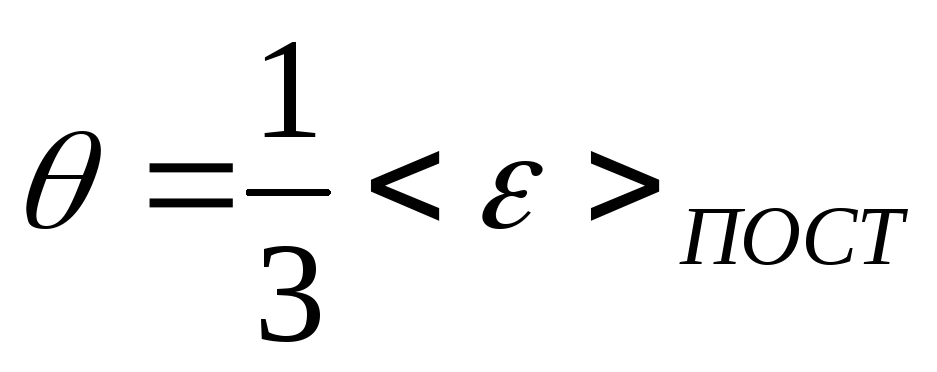 ,
выраженную непосредственно в
,
выраженную непосредственно в
![]() .
При таком определении многие формулы
теоретической физики и термодинамики
упрощаются и в теоретических исследованиях
часто так и поступают. Однако, для
практических целей измерение температуры
в энергетических единицах неудобно.
Например, нормальная температура
человеческого тела в энергетических
единицах равна
.
При таком определении многие формулы
теоретической физики и термодинамики
упрощаются и в теоретических исследованиях
часто так и поступают. Однако, для
практических целей измерение температуры
в энергетических единицах неудобно.
Например, нормальная температура
человеческого тела в энергетических
единицах равна
![]() .
Поэтому сохранена привычная система
измерения температуры в градусах.
.
Поэтому сохранена привычная система
измерения температуры в градусах.
С точки зрения МКТ абсолютная температура есть мера средней кинетической энергии поступательного движения молекул тела. В случае идеального газа абсолютная температура в К (Кельвин) равна:
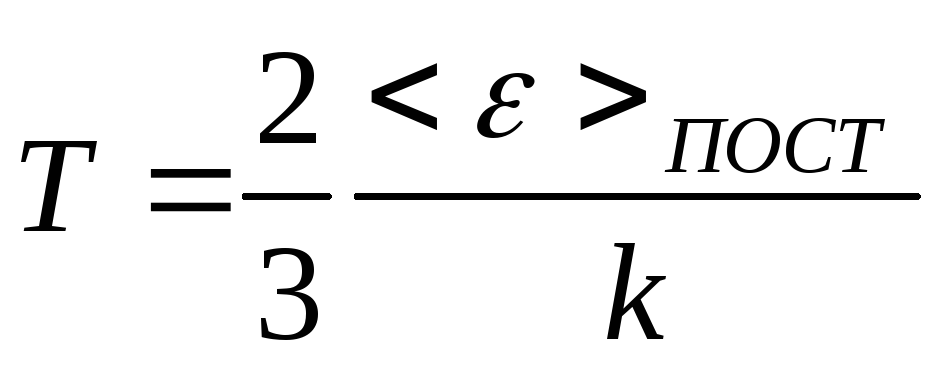 ,
,
где
![]() - постоянная Больцмана, является
переводным коэффициентом между
- постоянная Больцмана, является
переводным коэффициентом между
![]() и
и
![]() .
.
При таком определении температуры нулю
абсолютной температуры соответствует
![]() ,
таким образом, средняя кинетическая
энергия поступательного движения
молекул пропорциональна абсолютной
температуре:
,
таким образом, средняя кинетическая
энергия поступательного движения
молекул пропорциональна абсолютной
температуре:
![]() .
.
Используя последнее соотношение, выразим основное уравнение МКТ идеального газа через абсолютную температуру:
![]() .
.
Давление газа пропорционально
концентрации молекул
![]() ~
~![]() и абсолютной температуре
и абсолютной температуре
![]() ~
~![]() .
При
.
При
![]() температура является однозначной
функцией давления. Измерив давление
газа, можно вычислить температуру. На
этом принципе основано измерение
абсолютной температуры с помощью
газового термометра, который использует
газ, близкий по свойствам к идеальному
(достаточно разрежённый газообразный
водород).
температура является однозначной
функцией давления. Измерив давление
газа, можно вычислить температуру. На
этом принципе основано измерение
абсолютной температуры с помощью
газового термометра, который использует
газ, близкий по свойствам к идеальному
(достаточно разрежённый газообразный
водород).
При построении абсолютной шкалы используется единственная реперная точка – тройная точка воды, которая соответствует равновесию системы, состоящей из льда, воды и водяного пара. Единица измерения температуры (1 Кельвин) выбирается так, чтобы температура тройной точки воды оказалась точно на 273,16 К выше абсолютного нуля температуры.
Температура замерзания воды при
нормальном давлении по абсолютной шкале
равна
![]() .
Поэтому переход к температурам Цельсия
.
Поэтому переход к температурам Цельсия
![]() даётся формулой
даётся формулой
![]() .
При этом
.
При этом
![]() .
.
