
- •Лекция 1 Введение
- •Физика Предмет физики
- •Лекция 2 Механика
- •Кинематика материальной точки
- •Динамика.
- •Динамика материальной точки.
- •Первый закон Ньютона. Инерциальные системы отсчёта (исо). Принцип относительности. Преобразования Галилея.
- •Импульс частицы (количество движения)
- •Второй закон Ньютона. Понятие силы. Масса – мера инертности. Определение силы.
- •Закон независимости действия сил (принцип суперпозиции сил). Равнодействующая сил.
- •Интегральное выражение основного закона динамики. Понятие импульса силы.
- •Третий закон Ньютона.
- •Динамика систем материальных точек. Обобщение II закона Ньютона для системы материальных точек. Импульс системы. Закон сохранения импульса системы.
- •Центр инерции системы частиц (тела). Закон аддитивности массы.
- •Интегральное выражение основного закона динамики системы частиц. Закон сохранения проекции импульса системы.
- •Классификация сил. Фундаментальные воздействия. Законы эмпирических сил.
- •Закон всемирного тяготения.
- •Однородное поле тяжести Земли.
- •Понятие веса тела.
- •Упругие деформации. Закон Гука.
- •Силы трения.
- •Сухое трение.
- •Трение покоя.
- •Трение скольжения.
- •Трение качения.
- •Вязкое трение.
- •Сила сопротивления.
- •Сила Архимеда.
- •Реактивная сила.
- •Механическая энергия и её виды. Закон сохранения механической энергии.
- •Консервативные и неконсервативные силы.
- •Закон сохранения механической энергии.
- •Потенциальная энергия упругих взаимодействий.
- •Потенциальная энергия тяготения.
- •Теорема о потенциальной энергии. Связь между консервативной силой и потенциальной энергией.
- •Потенциальные кривые.
- •Основной закон динамики вращательного движения. Закон сохранения момента импульса системы частиц (тела).
- •Динамика материальной точки
- •Динамика системы материальных точек
- •Динамика вращательного движения тела относительно неподвижной оси.
- •Элементы динамики твёрдого тела.
- •Закон сохранения момента импульса относительно оси.
- •Кинетическая энергия вращения твёрдого тела.
- •Плоское движение твёрдого тела.
- •Теорема Штейнера.
- •Работа момента силы относительно оси.
- •Заключение.
- •Основы молекулярной физики и термодинамики. Введение
- •Элементы молекулярно-кинетической теории. Основные представления и понятия.
- •Модель идеального газа. Уравнение состояния идеального газа.
- •Основное уравнение молекулярно-кинетической теории идеального газа.
- •Температура
- •Тепловая скорость молекул газа.
- •Вывод уравнения состояния идеального газа.
- •Барометрическая формула. Закон Больцмана.
- •Закон равномерного распределения энергии по степеням свободы молекул газа.
- •Внутренняя энергия идеального газа.
- •Распределение молекул по скоростям (закон Максвелла).
- •Распределение по кинетическим энергиям поступательного движения молекул газа.
- •Явление переноса
- •Явление теплопроводности. Закон Фурье.
- •Явление диффузии. Закон Фика
- •Вязкое трение. Закон ньютона.
- •Явление переноса в газах.
- •Средняя частота столкновений и средняя длина свободного пробега молекул газа.
- •Диффузия в газах.
- •Теплопроводность газов.
- •Вязкость газов.
- •Внутренняя энергия термодинамической системы. Работа и теплота как обобщённые формы обмена энергией в термодинамике.
- •Первое начало термодинамики.
- •Равновесные процессы.
- •Применение первого начала термодинамики к равновесным процессам с идеальным газом. Изотермический процесс.
- •Изохорный процесс.
- •Изобарный процесс.
- •Адиабатный процесс.
- •Политропный процесс.
- •Круговые процессы. Цикл Карно. Кпд тепловых машин.
- •Второе начало термодинамики.
- •Теорема Карно и Клаузиуса.
- •Энтропия.
- •Основное уравнение термодинамики обратимых процессов.
- •Примеры расчёта энтропии для обратимых процессов. Энтропия идеального газа.
- •Изменение энтропии при обратимом нагреве (охлаждении) жидких и твёрдых тел.
- •Изменение энтропии при фазовых превращениях.
- •Подведём итоги об энтропии и её свойствах.
- •Примеры роста энтропии в изолированных системах.
- •Расширение идеального газа в пустоту.
- •Формула Больцмана. Статистический смысл энтропии.
Модель идеального газа. Уравнение состояния идеального газа.
Газ как макроскопический объект не имеет собственного объёма, представляет собой совокупность молекул, движение которых подчиняется законам классической механики.
Если некоторая масса газа m занимает объём V, при заданной температуре T, в этом объёме устанавливается давление P. Величины m, P, V, T и являются макроскопическими параметрами газа. Эти параметры связаны уравнением состояния газа. В случае однородного и достаточно разреженного газа из частных эмпирических газовых законов было получено уравнение состояния газа:
![]() ,
,
где M – молярная масса
газа,
![]() - универсальная газовая постоянная.
- универсальная газовая постоянная.
Это уравнение, известное школьникам как уравнение Клапейрона-Менделеева, является уравнением состояния идеального газа.
Основное уравнение молекулярно-кинетической теории идеального газа.
Молекулярно-кинетическая теория позволяет описать свойства идеального газа и вывести его уравнение состояния. При этом используется следующая классическая модель.
Идеальный газ представляет собой совокупность хаотически движущихся по законам классической механики, упругих шариков, исчезающее малых размеров, взаимодействующих только в момент соударений между собой и со стенками сосуда.
Рассмотрим однородный газ, находящийся в изолированном неподвижном сосуде с непроницаемыми и гладкими стенками.
Молекулы (атомы) как упругие шарики
движутся от столкновения до столкновения
свободно со скоростью поступательного
движения
![]() .
Каждая молекула имеет свою скорость
.
Каждая молекула имеет свою скорость
![]() .
.
Очевидно, все макроскопические свойства
такого газа, связанные со скоростью
движения его молекул, будут определяться
не индивидуальными скоростями каждой
молекулы, а средней скоростью всех
молекул газа
![]() .
Но так как газ в целом, как механическая
система, покоится, то
.
Но так как газ в целом, как механическая
система, покоится, то
![]() .
.
Отлично от нуля среднее значение модуля
скорости
![]() ,
а также квадрата скорости
,
а также квадрата скорости
![]() .
.
Величина
![]() называется средней квадратичной
скоростью молекул газа (тепловой
скоростью молекул газа) и определяется
соотношением:
называется средней квадратичной
скоростью молекул газа (тепловой
скоростью молекул газа) и определяется
соотношением:
![]() ,
,
где N – число молекул газа.
Рассматриваемый газ находится в состоянии теплового равновесия и в целом неподвижен, откуда следует:
 .
.
От столкновения до столкновения молекулы
движутся свободно некоторое время
![]() .
Среднее значение
.
Среднее значение
![]() ,
вычисленное для всех молекул газа,
называется средним временем
свободного пробега
,
вычисленное для всех молекул газа,
называется средним временем
свободного пробега
![]() .
.
За время
![]() молекула проходит путь
молекула проходит путь
![]() .
Среднее значение
.
Среднее значение
![]() для всех молекул газа называется средней
длиной свободного пробега
для всех молекул газа называется средней
длиной свободного пробега
![]() .
Таким образом, по истечении времени
.
Таким образом, по истечении времени
![]() молекула в среднем претерпевает одно
соударение. Длительность столкновения
молекула в среднем претерпевает одно
соударение. Длительность столкновения
![]() определяется размерами молекул (шариков).
В принятой модели
определяется размерами молекул (шариков).
В принятой модели
![]() .
Следовательно, молекулы идеального
газа основное время проводят в состоянии
свободного движения, не взаимодействуя
друг с другом.
.
Следовательно, молекулы идеального
газа основное время проводят в состоянии
свободного движения, не взаимодействуя
друг с другом.
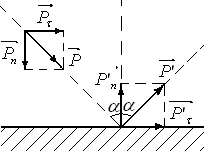 Газ
оказывает давление на стенки сосуда,
механизм которого связан с процессом
столкновения молекул газа с поверхностью
сосуда. При столкновении упругих шариков
с массивной гладкой поверхностью
изменяется только нормальная к поверхности
составляющая импульса (см. рисунок):
Газ
оказывает давление на стенки сосуда,
механизм которого связан с процессом
столкновения молекул газа с поверхностью
сосуда. При столкновении упругих шариков
с массивной гладкой поверхностью
изменяется только нормальная к поверхности
составляющая импульса (см. рисунок):
![]()
![]() .
.
Поверхность при этом получает импульс
в направлении нормали
![]() ,
где
,
где
![]() - масса молекулы (шарика).
- масса молекулы (шарика).
 Для
упрощения схемы расчёта рассмотрим
сосуд в форме куба со стороной
Для
упрощения схемы расчёта рассмотрим
сосуд в форме куба со стороной
![]() (см. рисунок).
(см. рисунок).
Найдём силу, действующую на заштрихованную грань, перпендикулярную оси Ox.
Импульс, полученный гранью при столкновении
с
![]() молекулой, равен
молекулой, равен
![]() .
.
Так как промежуточными столкновениями можно пренебречь, учитывая эстафетный характер передачи импульса при упругом столкновении и малость времени соударения между молекулами (шарами), то для i-й молекулы время между двумя соседними столкновениями с выделенной гранью составит
![]() ,
,
то есть
![]() молекула
за 1с столкнётся с выделенной гранью
молекула
за 1с столкнётся с выделенной гранью
![]() раз.
раз.
Таким образом,
![]() молекула за 1с передаёт выделенной грани
импульс
молекула за 1с передаёт выделенной грани
импульс
![]() .
.
Все N молекул газа передают за 1с импульс выделенной грани
![]() .
.
Изменение импульса стенки в единицу времени – есть сила.
.
Учитывая, что
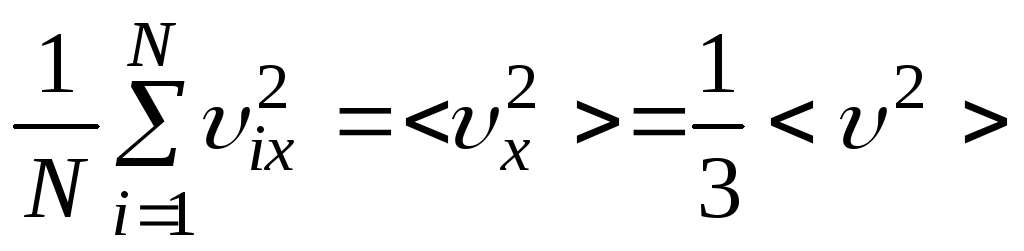 ,
,
получаем
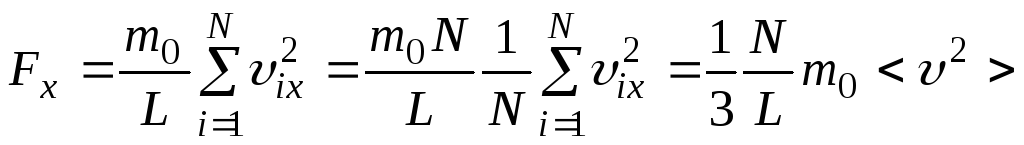 .
.
Давление газа на выделенную грань равно:
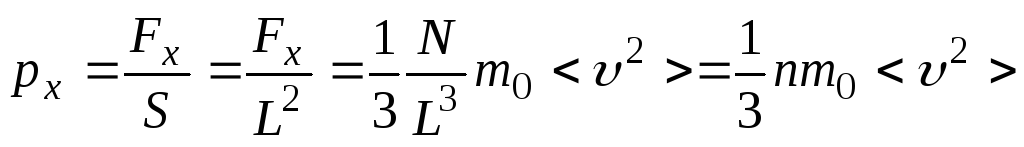 ,
,
где
![]() - концентрация молекул газа.
- концентрация молекул газа.
Правая часть полученного соотношения
не зависит от индекса «x»
и поэтому по аналогии можно записать:
![]() ,
где
,
где
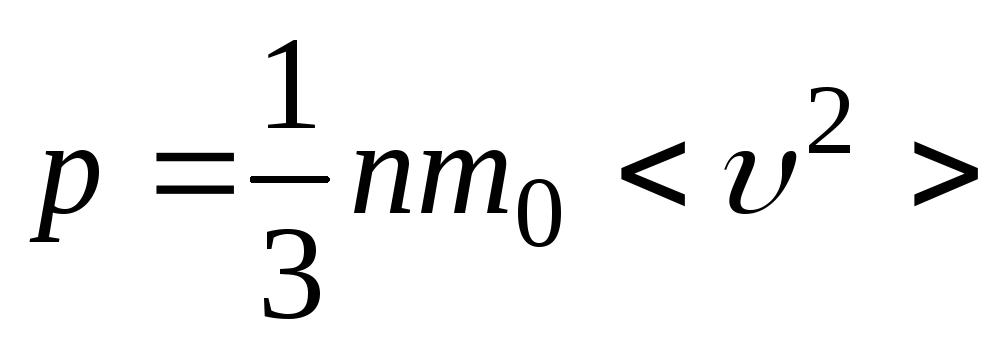 .
.
Давление газа не зависит от направления, т.е. обладает свойством изотропии.
Полученное соотношение называется
основным уравнением молекулярно-кинетической
теории (МКТ) идеального газа. Оно
связывает макрохарактеристику газа
давление p с микрохарактеристиками
молекул газа
![]() .
.
Отметим, что основное уравнение хорошо выполняется и для реальных газов, при невысоких давлениях, хотя молекулы последних и не являются упругими шариками, а их отражение от стенок сосуда в общем случае не подчиняется закону зеркального отражения и существенно зависит от свойств поверхности сосуда. Однако в равновесных условиях касательная составляющая импульсов отдельных молекул во всех случаях не даёт вклада в конечный результат, а нормальные составляющие (по закону сохранения импульса) определяют давление газа.
Основное уравнение МКТ идеального газа можно представить в более обобщённой форме через среднюю кинетическую энергию поступательного движения молекул газа:
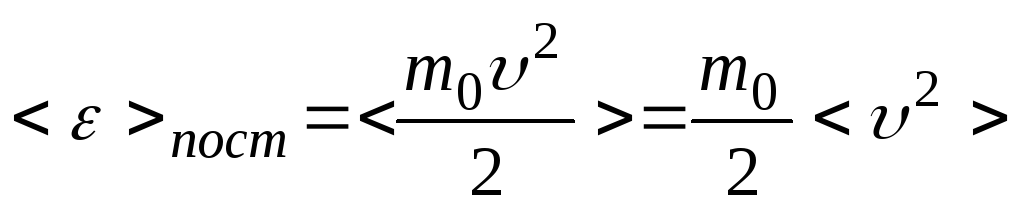 .
.
Используя последнее соотношение для давления газа, находим:
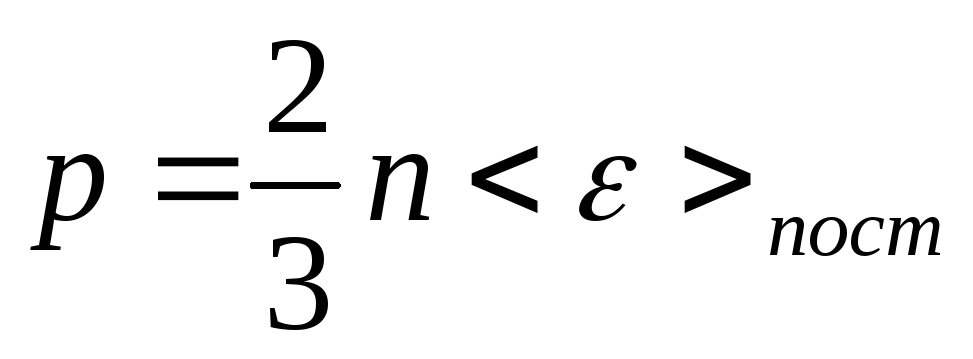 .
.
В таком представлении основное уравнение
применимо и для неоднородного газа, где
![]() ,
,
![]() - концентрация молекул
- концентрация молекул
![]() сорта,
сорта,
![]() - средняя кинетическая энергия
поступательного движения молекул
неоднородного газа.
- средняя кинетическая энергия
поступательного движения молекул
неоднородного газа.
При этом общее давление неоднородного газа равно сумме
![]() ,
,
где
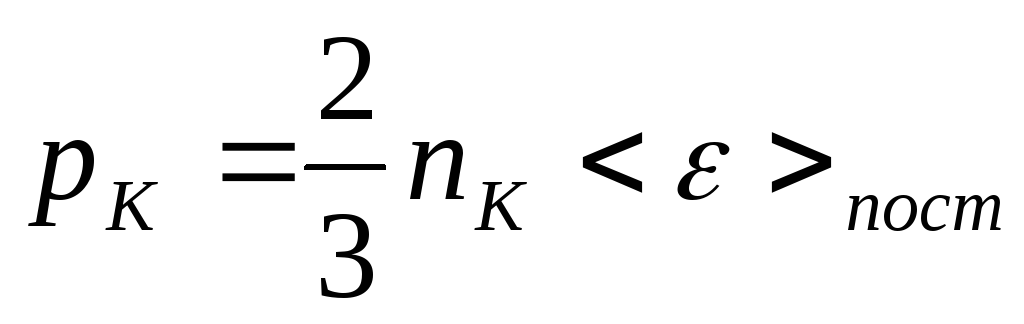 - давление молекул
- давление молекул
![]() сорта, называется парциальным давлением.
сорта, называется парциальным давлением.
Последнее соотношение называется законом Дальтона в честь английского химика и физика, открывшего этот закон в 1801г.
Произведение
![]() равно плотности кинетической энергии
поступательного движения молекул
идеального газа
равно плотности кинетической энергии
поступательного движения молекул
идеального газа
![]() .
.
Основное уравнение можно представить также в форме:
![]() .
.
Лекция 10.
