
- •Термохимия и кинетика
- •Термохимия
- •Примеры решения задач
- •Контрольные вопросы и задачи
- •Домашние задания. Термохимия
- •Кинетика Скорость химических реакций и химическое равновесие
- •Примеры решения задач
- •Контрольные вопросы и задачи
- •Домашние задания. Кинетика
- •Типовой билет проверочной работы по теме «Кинетика и термохимия»
- •Библиографический список
- •105066, Москва, ул. Старая Басманная, 21/4
Примеры решения задач
Пример 1.
При образовании
1,8 г воды (H2O(ж))
из газообразных водорода и кислорода
выделилось 28,6 кДж тепла. Вычислить
энтальпию образования H2O(ж)
и написать
уравнение реакции, тепловой эффект
которой равен
![]() .
.
Решение. 1-й способ.
Так как 1 моль воды равен 18 г, то энтальпию образования
1 моль H2O(ж) можно вычислить
![]() кДж/моль,
кДж/моль,
что соответствует уравнению
![]()
![]() кДж/моль.
кДж/моль.
2-й способ: Из условия: H=-28,6 кДж.
По определению:
![]() ;
;
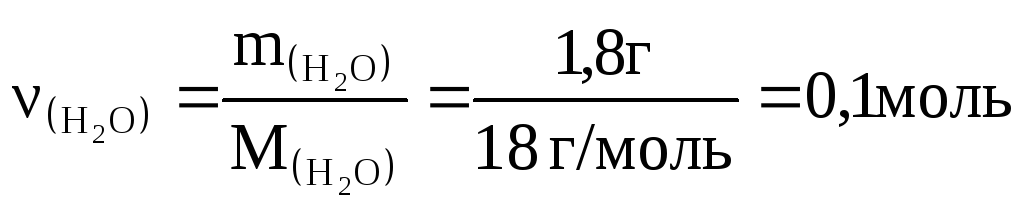
Следовательно,
![]() кДж/моль.
кДж/моль.
Пример 2.
Вычислить энтальпию образования N2O5(кр), если известен тепловой эффект реакции
N2O5(к)+2KOH(к)=2KNO3(к)+H2O(ж);
![]() кДж,
кДж,
а также энтальпии образования KOH(к), KNO3(к) и H2O(ж),
которые соответственно равны
-425,0;-493,2 и –286,0 (кДж/моль).
Решение
Используя следствие из закона Гесса, запишем
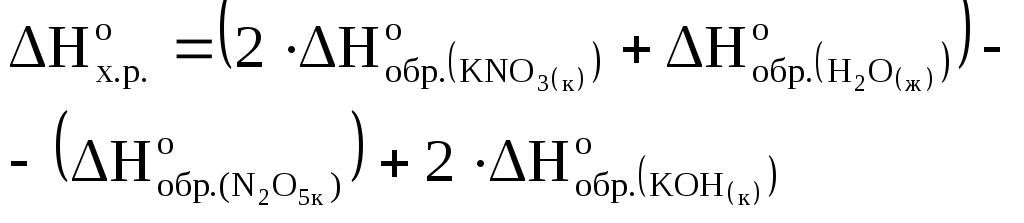
Подставим данные из условия и получим
-380,6=(2-493,2-286)-(![]() +2-425)
+2-425)
Проводим арифметические вычисления:
-380,6=-422,4-![]() .
.
Отсюда
![]() кДж/моль
кДж/моль
Пример 3.
Сколько выделится теплоты при получении 1 кг железа по реакции
Fe2O3(к)+3СО(г)=2Fe(к)+3СО2(г),
если энтальпии образования Fe2O3(к), СО(г) и СО2(г)
соответственно равны (кДж/моль):
-822,7; -110,6 и -394,0.
Решение
1.Вычисляем тепловой эффект реакции (H), используя следствие из закона Гесса.
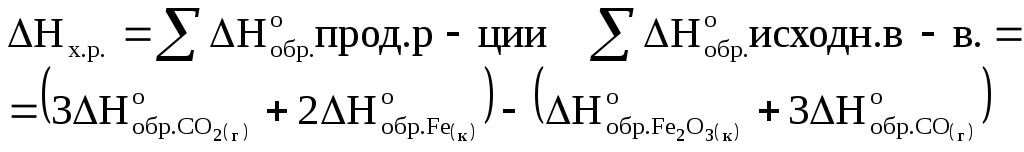
Так как энтальпия
образования простого вещества принимается
равной нулю то,
![]() .
.
Тогда
![]() кДж
кДж
-
Проведем расчет по термохимическому уравнению:
если образуется 256г Fe, то выделяется 27,2 кДж;
если образуется 1000г Fe, то выделяется х кДж.
Решаем пропорцию и получаем
![]() кДж,
т.е.
кДж,
т.е.
выделится 242,9 кДж теплоты.
Контрольные вопросы и задачи
-
Что называется тепловым эффектом химической реакции (H)?
-
Перечислите факторы, влияющие на тепловой эффект химической реакции (H).
-
Какие реакции называются экзотермическими и эндотермическими? Приведите примеры.
-
Какой знак имеет тепловой эффект (H) для экзотермических и эндотермических реакций?
-
Дайте определение стандартной энтальпии образования сложного вещества
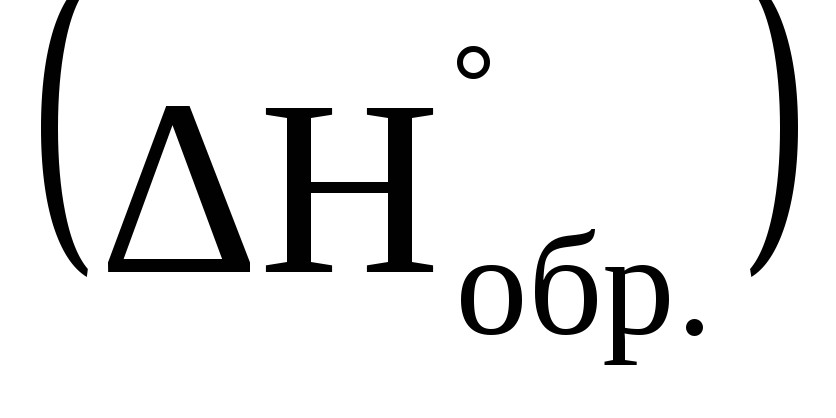 .
. -
Дайте формулировку закона Гесса.
-
Сформулируйте следствия из закона Гесса.
-
При взаимодействии 1 моль водорода и 1 моль хлора выделяется 184 кДж. Чему равна энтальпия образования хлористого водорода
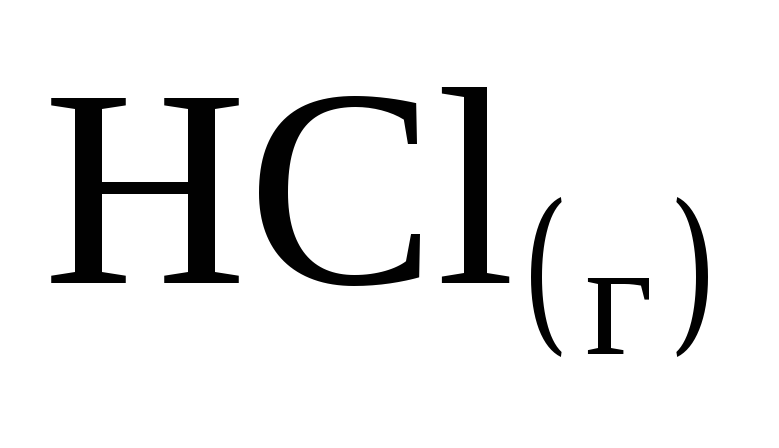 ?
? -
На разложение 1 моль бромистого водорода на простые вещества требуется затратить 72 кДж теплоты. Чему равна энтальпия образования HBr?
-
При образовании 2 моль газообразного HCl выделяется 184 кДж. Чему равна энтальпия образования
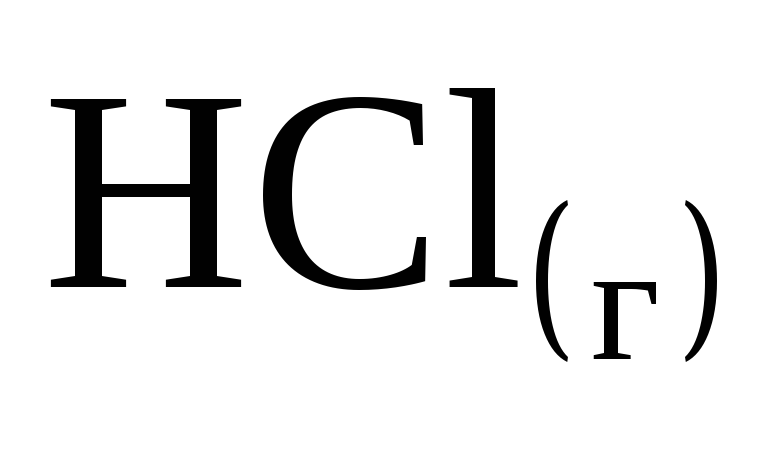 ?
? -
Чему равен тепловой эффект разложения 1 моль хлористого водорода на простые вещества, если
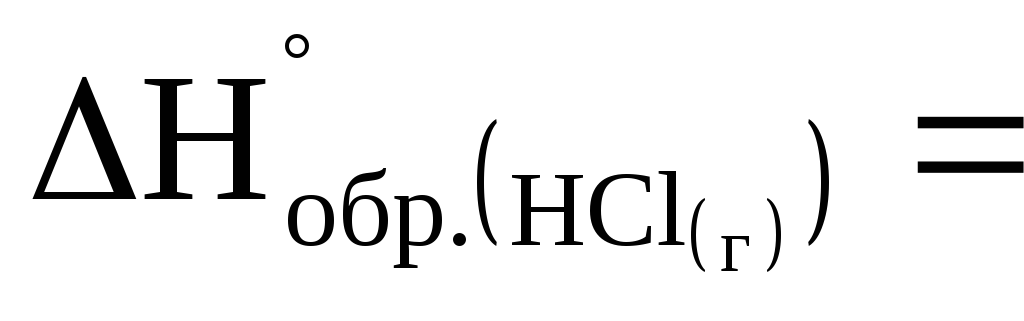
= -92 кДж/моль?
-
При образовании 2 моль паров воды выделилось
490,2 кДж. Чему равна
энтальпия образования
![]() ?
?
-
При полном сгорании 1 моль водорода в кислороде выделилось 245,1 кДж. Чему равна энтальпия образования
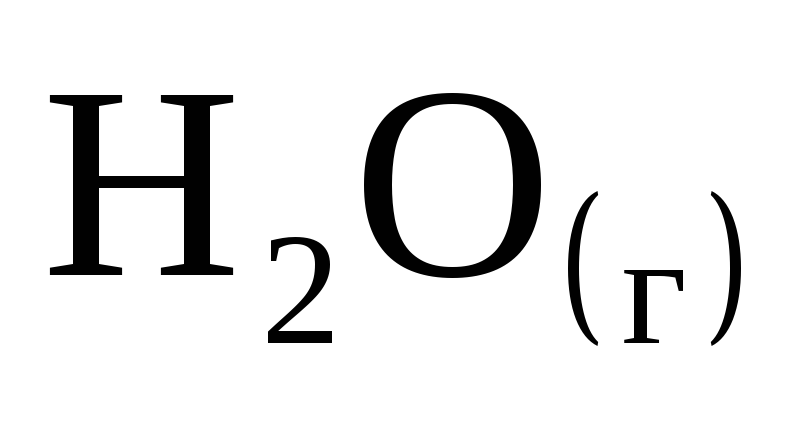 ?
? -
Определите тепловой эффект (Hо) реакции разложения 2 молей йодистого водорода на простые вещества, если
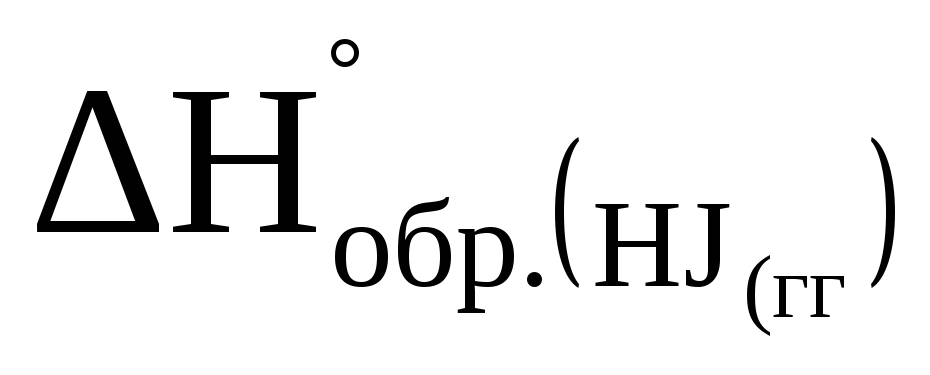 =26
кДж/моль.
=26
кДж/моль. -
Сколько выделится теплоты при сжигании 1 кг алюминия, если
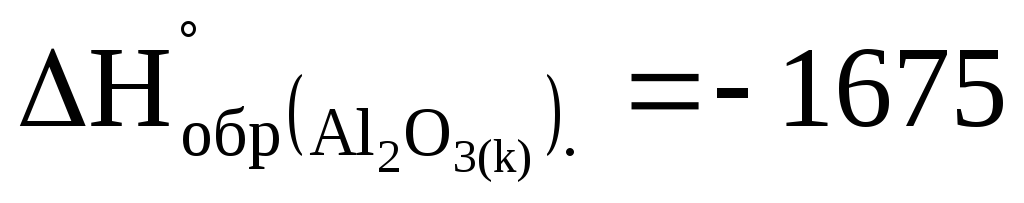 кДж/моль.
кДж/моль. -
При сжигании какого количества магния выделяется 1000 кДж, если
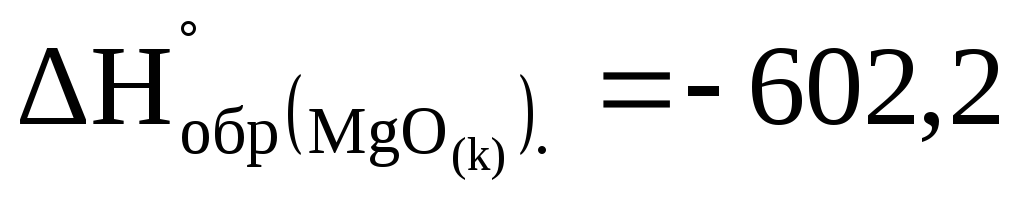 кДж/моль?
кДж/моль? -
Сколько тепла выделяется при разложении 260 г ацетилена
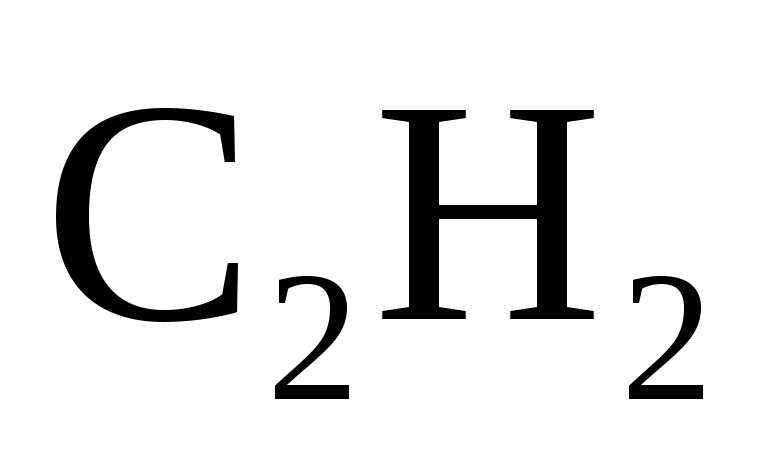 на простые вещества, если
на простые вещества, если
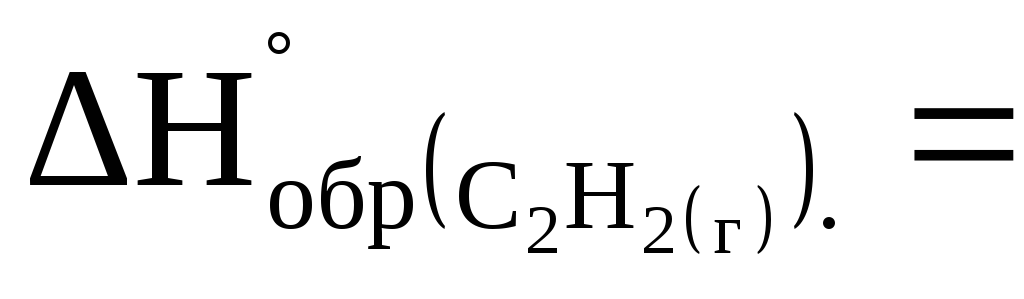
= 226,9 кДж/моль?
-
Сколько тепла выделится при разложении 4,4 г оксида азота (I) на азот и кислород, если
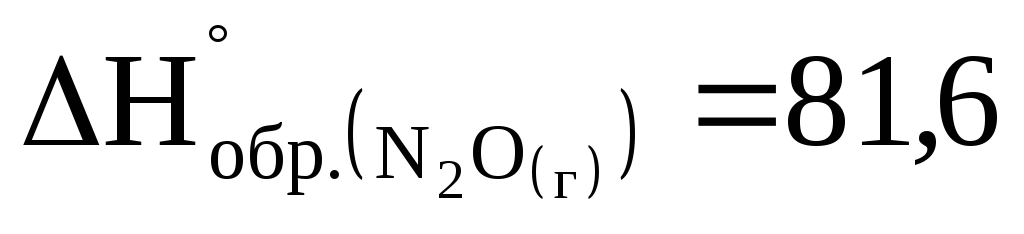 кДж/моль.
кДж/моль. -
При взаимодействии 10 г водорода с хлором выделяется 920 кДж. Чему равна энтальпия образования
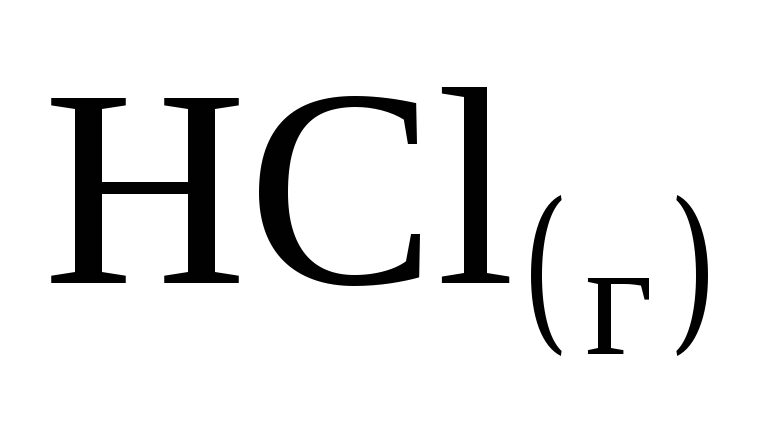 ?
? -
Вычислите энтальпию образования оксида фосфора (V), если при сгорании 4 г фосфора выделяется 97,2 кДж.
-
При разложении 3 г оксида азота (II) на простые вещества выделяется 9,13 кДж. Определите
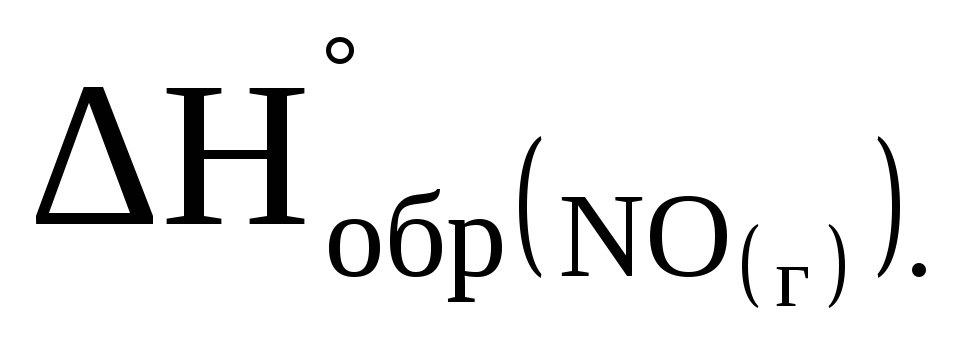 .
. -
Определите тепловой эффект
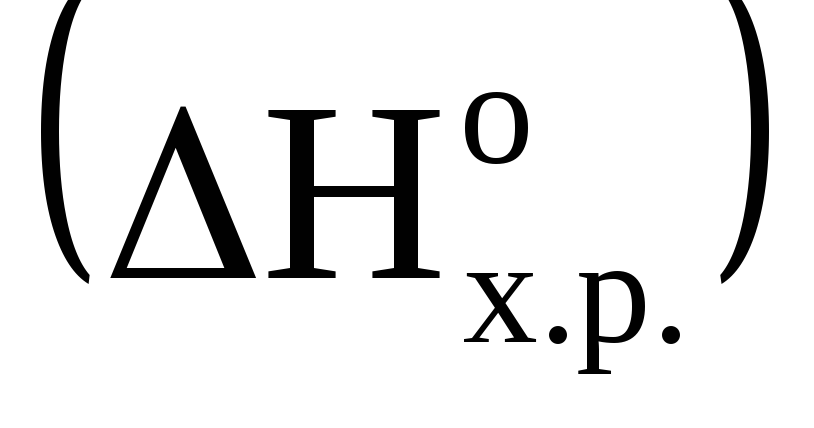 реакции 2Mg(к)+CO2(г)=2MgO(k)+C(k),
если
реакции 2Mg(к)+CO2(г)=2MgO(k)+C(k),
если
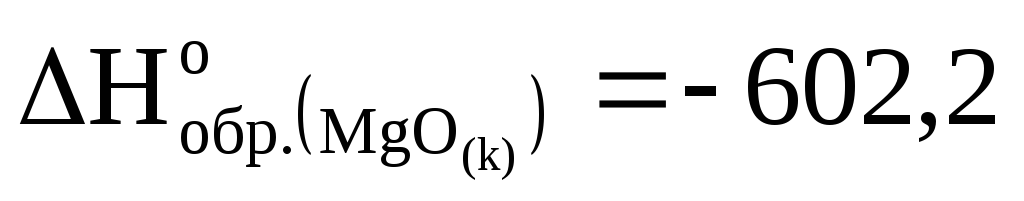 кДж/моль
и
кДж/моль
и
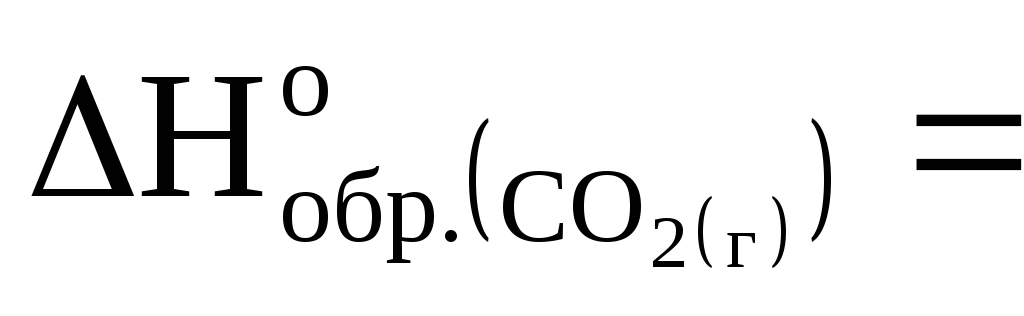
= -393,5кДж/моль. Вычислите, сколько выделится теплоты при сгорания 2,4 г магния в диоксиде углерода.
-
Сероуглерод сгорает согласно уравнению
CS2(ж)
+ 3O2(г)
= CO2(г)
+ 2SO2(г),
![]() = -1103 кДж.
= -1103 кДж.
Рассчитайте
стандартную энтальпию образования
сероуглерода, если
![]() кДж/моль и
кДж/моль и
![]() кДж/моль.
кДж/моль.
Вычислите, сколько теплоты выделится при сгорании 150 г сероуглерода.
-
Определите
 стандартную
энтальпию химической реакции
стандартную
энтальпию химической реакции
4NH3(г)
+ 5О2(г)
= 4NO(г)
+ 6H2O(ж),
если
![]()
= 91,3 кДж/моль,
![]() кДж/моль и
кДж/моль и
![]() кДж/моль.
кДж/моль.
Рассчитайте, сколько выделится теплоты при окислении
44,8 л (н.у.) аммиака.
-
Рассчитайте стандартную энтальпию образования пероксида водорода
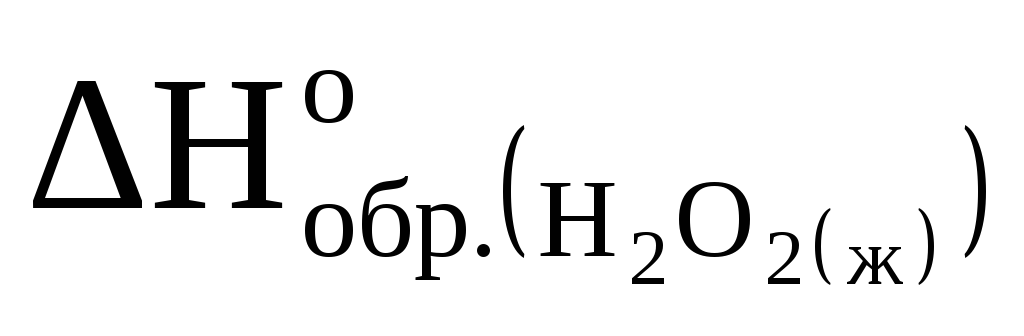 ,
если его разложение происходит по
реакции
,
если его разложение происходит по
реакции
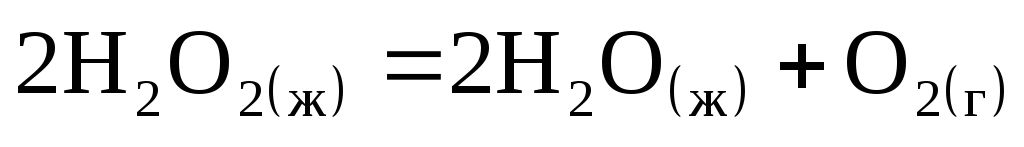
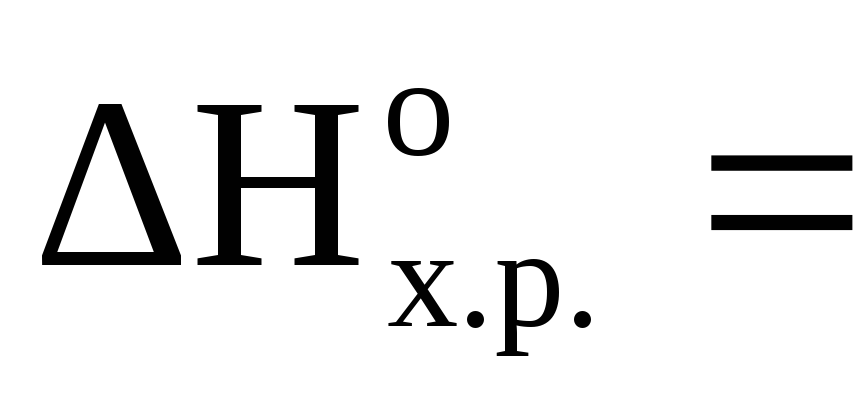
= -196,4 кДж, а
![]() кДж/моль.
кДж/моль.
Сколько выделится теплоты при разложении 100 г пероксида водорода?
-
Рассчитайте, сколько потребуется теплоты для получения 650 г цинка по реакции ZnO + C = Zn + CO, если
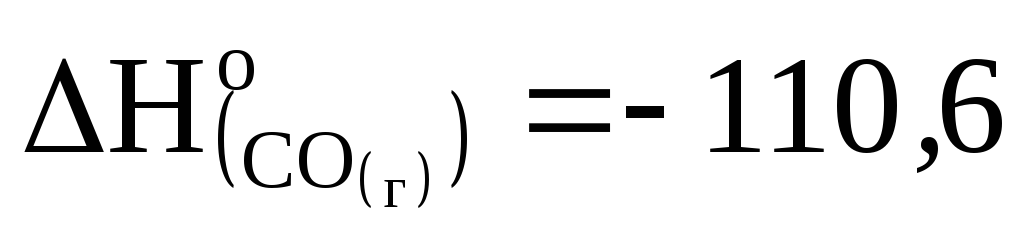 кДж/моль, а
кДж/моль, а
![]() кДж/моль.
кДж/моль.
-
Рассчитайте стандартную энтальпию образования H2S(г), если при его сгорании по уравнению 2H2S(г)+3O2(г)=2H2O(г)+2SO2(г) выделяется 1037 кДж, а
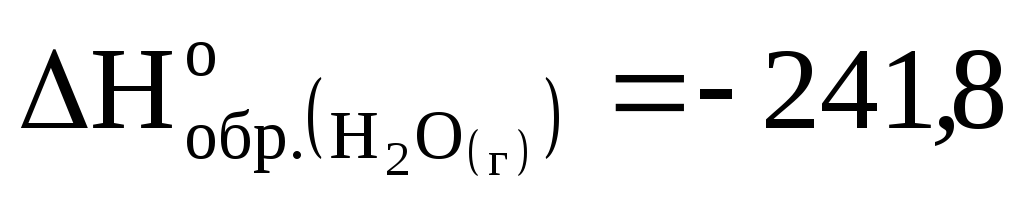 кДж/моль,
кДж/моль,
![]() кДж/моль.
кДж/моль.
Вычислите, сколько тепла выделится при сгорании 11,2 л (н.у.) H2S.
-
Сера сгорает в закиси азота (N2O) согласно уравнению 2N2O(г)+S(ромб.)=2N2(г)+SO2(г).
Сколько тепла
выделится при сгорании 5 г ромбической
серы в закиси азота, если
![]() кДж/моль,
кДж/моль,
а
![]() кДж/моль?
кДж/моль?
