
- •И.С. Колпащикова, е.Р. Кофанов, е.М. Алов углеводороды. Галогенпроизводные углеводородов
- •1. Алканы
- •1.1. Гомологический ряд, изомеры
- •Гомологический ряд алканов. Число структурных изомеров
- •1.2. Строение метана
- •1.3. Строение этана
- •1.4. Вращение вокруг простой углерод-углеродной связи. Конформации
- •1.5. Физические свойства
- •1.6. Химические свойства
- •1.6.1. Хлорирование и бромирование метана. Механизм реакции
- •1.6.2. Строение метильного радикала
- •1.6.3. Расчет изменения энергии в ходе реакции
- •1.6.4. Энергетическая диаграмма реакции. Связь энергии
- •Хлорирования метана
- •Бромирования метана
- •1.6.5. Причина различной реакционной способности галогенов
- •Зависимость реакционной способности галогенов от энергии связи h–Hal
- •1.6.6. Галогенирование высших алканов. Механизм
- •1.6.7. Медленная стадия. Энергетическая диаграмма
- •1.6.8. Причина различной устойчивости радикалов
- •1.6.9. Зависимость скорости образования радикалов
- •1.6.10. Расчет реакционной способности различных связей
- •1.6.11. Селективность в реакциях хлорирования
- •Малореакционного Br• с пропаном
- •1.6.12. Нитрование
- •1.6.13. Сульфоокисление и сульфохлорирование
- •1.6.14. Окисление
- •1.6.15. Термическое разложение алканов, крекинг
- •1.6.16. Ионные реакции алканов
- •1.7. Методы синтеза алканов
- •1.7.1. Гидрирование алкенов и алкинов
- •1.7.2. Реакция Вюрца
- •2.2. Плоскополяризованный свет. Оптическая активность
- •2.3. Строение молекул и оптическая активность
- •2.4. Обозначение конфигураций
- •2.5. Соединения с несколькими хиральными центрами.
- •2.6. Методы разделения энантиомеров
- •3. Циклоалканы
- •3.1 Номенклатура. Изомерия
- •3.2. Физические свойства
- •3.3. Строение
- •Теплоты сгорания и энергии напряжения циклоалканов
- •3.4. Химические свойства
- •3.5. Способы получения
- •4.2. Строение этена
- •4.3. Физические свойства
- •Физические свойства алкенов
- •4.4. Химические свойства
- •4.4.1. Гидрирование. Теплота гидрирования
- •4.4.2. Теплота гидрирования и устойчивость алкенов
- •4.4.3. Присоединение галогенов
- •4.4.3.1. Механизм реакции
- •4.4.3.2. Реакционная способность галогенов в реакции АdЕ
- •4.4.4. Присоединение галогеноводородов
- •4.4.4.1. Механизм реакции
- •4.4.4.2. Направление электрофильного присоединения
- •К пропену
- •4.4.4.3. Реакционная способность и селективность
- •4.4.4.4. Перегруппировка
- •Механизм реакции
- •4.4.5. Присоединение бромистого водорода в присутствии
- •1. Инициирование:
- •2. Рост цепи:
- •3. Обрыв цепи:
- •4.4.6. Присоединение серной кислоты
- •4.4.7. Гидратация алкенов. Присоединение спиртов
- •4.4.8. Гидроборирование алкенов
- •4.4.9. Алкилирование алкенов
- •4.4.10. Полимеризация алкенов
- •4.4.11. Окисление
- •4.4.12. Реакция аллильного замещения. Галогенирование
- •Характеристики химических связей в молекуле алкинов
- •Характеристики связей с-н в алканах, алкенах и алкинах
- •5.2. Физические свойства
- •5.3. Химические свойства
- •5.3.1. Реакции присоединеня
- •5.3.1.1. Каталитическое гидрирование и восстановление
- •5.3.1.2. Реакции электрофильного присоединения Галогенирование
- •Гидрогалогенирование
- •Гидратация
- •5.3.1.3. Нуклеофильное присоединение
- •5.3.2. Кислотность алкинов
- •Константы кислотности некоторых соединений
- •5.3.3. Взаимодействие алкинов с карбонильными соединениями
- •5.3.4. Окисление алкинов
- •5.3.5. Радикальное присоединение бромоводорода
- •5.4. Способы получения
- •6. Диены
- •6.1. Устойчивость сопряженных диенов
- •Теплоты гидрирования алкенов и диенов
- •Гибридизация атомов углерода и длины простых углерод-углеродных связей
- •6.2. Химические свойства
- •6.2.1. Электрофильное присоединение
- •6.2.3. Диеновый синтез. Реакция Дильса-Альдера
- •6.2.4. Полимеризация
- •6.3. Способы получения
- •7. Арены
- •7.1. Сравнение свойств бензола со свойствами алкенов
- •Сравнение химических свойств циклогексена и бензола
- •7.2. Теплота гидрирования. Энергия резонанса
- •7.3. Строение бензола
- •7.4. Ароматичность
- •7.5. Физические свойства
- •Физические свойства аренов
- •7.6. Химические свойства
- •7.6.1. Электрофильное замещение
- •7.6.1.1. Нитрование
- •Превращения -комплекса
- •1.6.1.2. Галогенирование
- •7.6.1.3. Сульфирование
- •7.6.1.3. Алкилирование по Фриделю-Крафтсу
- •7.6.1.4. Ацилирование
- •7.6.1.5. Хлорметилирование
- •7.6.1.6. Формилирование
- •7.6.2. Свободнорадикальное замещение в боковой цепи аренов
- •7.6.3. Реакции окисления
- •7.7. Методы синтеза
- •8. Электрофильное замещение в производных
- •8.1. Влияние заместителей на реакционную способность
- •8.2. Механизм ориентации - влияние заместителей на выбор
- •Классификация заместителей. Электронные эффекты
- •9. Многоядерные ароматические соединения
- •9.1. Нафталин
- •9.1.1. Строение нафталина
- •9.1.2. Химические свойства
- •9.1.2.1. Реакции электрофильного замещения
- •9.1.2.2. Ориентация в реакциях электрофильного замещения
- •9.1.2.3. Восстановление и окисление нафталина
- •9.2. Антрацен и фенантрен
- •10. Гетероциклические соединения
- •10.1. Пятичленные гетероциклы
- •10.1.1. Строение
- •10.1.2. Химические свойства
- •10.1.3. Способы получения
- •10.2. Пиридин
- •10.2.1. Строение пиридина
- •10.2.2. Химические свойства
- •10.3. Хинолин
- •11. Галогеналканы
- •11.1. Нуклеофильное замещение
- •Реакции нуклеофильного замещения
- •11.1.1. Бимолекулярное нуклеофильное замещение
- •Бимолекулярного нуклеофильного замещения, sn2 - процесс согласованный одностадийный:
- •11.1.2. Мономолекулярное нуклеофильное замещение
- •Мономолекулярного нуклеофильного замещения. Sn1-двухстадийный процесс
- •Мономолекулярного нуклеофильного замещения
- •11.1.3. Сравнение реакций sn 1 и sn 2
- •Влияние условий реакции на относительное значение двух механизмов
- •11.1.4. Амбидентные ионы
- •11.2. Реакции отщепления (элиминирование)
- •11.2.1. Бимолекулярное отщепление е2
- •Состав продуктов е2-реакции 2-замещенных пентанов (под действием c2h5oөk)
- •Состав продуктов реакции трет-пентилбромида с алкоголятами калия roөk (70-75о с)
- •5.2.2. Мономолекулярное отщепление е1
- •11.2.3. Сравнение реакций нуклеофильного замещения и элиминирования
- •12.2. Нуклеофильное замещение, протекающее через стадию образования дегидробензола. Отщепление – присоединение
- •12.3. Бимолекулярное нуклеофильное замещение путем
- •12.4. Ориентация при нуклеофильном замещении
- •13. Магнийорганические соединения
- •13.1. Получение и строение магнийорганических соединений
- •13.2. Синтез спиртов и кислот
- •Оглавление
- •Углеводороды. Галогенпроизводные углеводородов
- •150023, Ярославль, Московский пр., 88
- •150000, Ярославль, ул. Советская, 14а
- •И.С. Колпащикова, е.Р.Кофанов, е.М.Алов
- •Углеводороды.
- •Галогенпроизводные углеводородов
4.4.3. Присоединение галогенов
Алкены реагируют с бромом и хлором в инертном растворителе (например, в четыреххлористом углероде), образуя вицинальные дигалогениды (vicinalis - соседний).
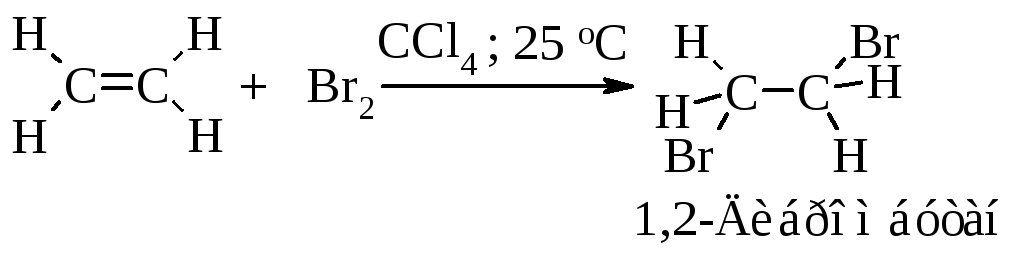
Этот процесс протекает как электрофильное присоединение.
4.4.3.1. Механизм реакции
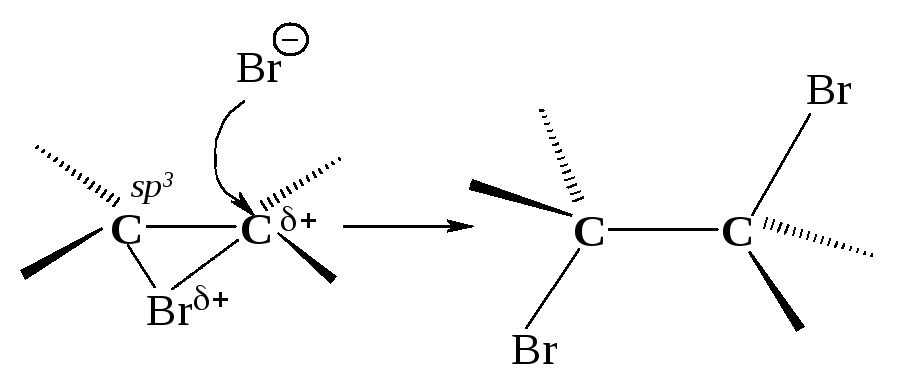
Первая стадия. Неполярная молекула галогена поляризуется под действием богатой электронами двойной углерод-углеродной связи. Изменение распределения электронной плотности в одной молекуле под влиянием внешних условий (растворитель, другие молекулы, ионы) называется поляризацией. Поляризованная таким образом молекула галогена взаимодействует с -cистемой, образуя -комплекс:
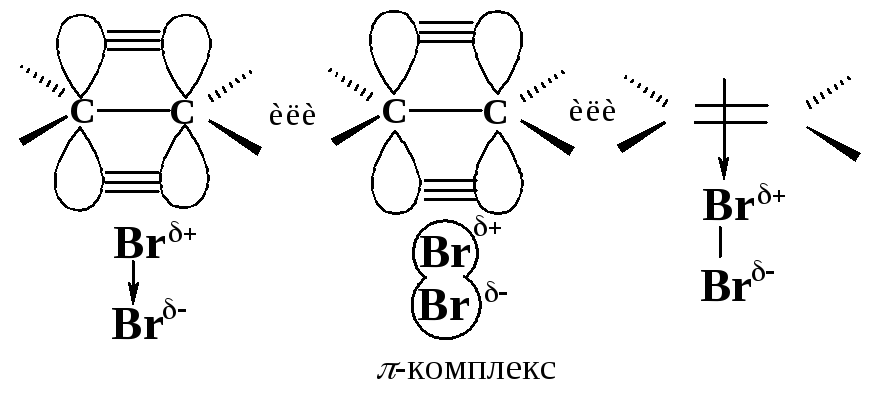
Вторая стадия. -Комплекс разрушается, ион брома Вr- электрофил - присоединяется к атому углерода и образуется -комплекс - карбокатион. Вторая стадия - медленная, определяет скорость всего процесса.
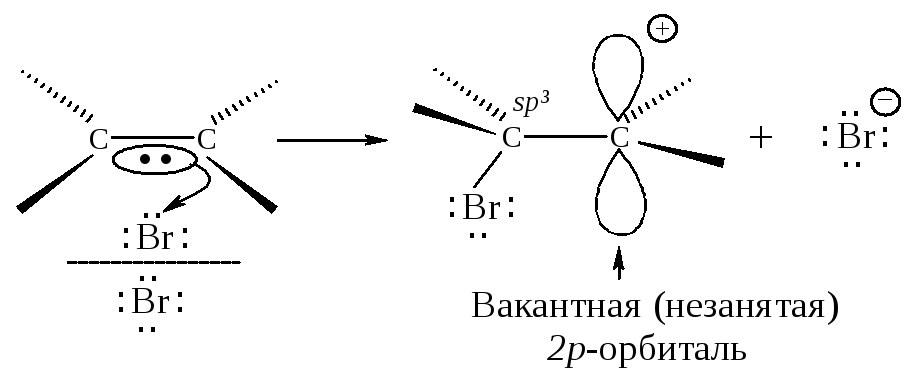
Положительно заряженный атом углерода находится в sр2-гибридизованном состоянии (его 2р-орбиталь не занята). Свободная 2р-орбиталь перекрывается с неподеленной парой электронов атома брома, образуя циклический ион бромония.
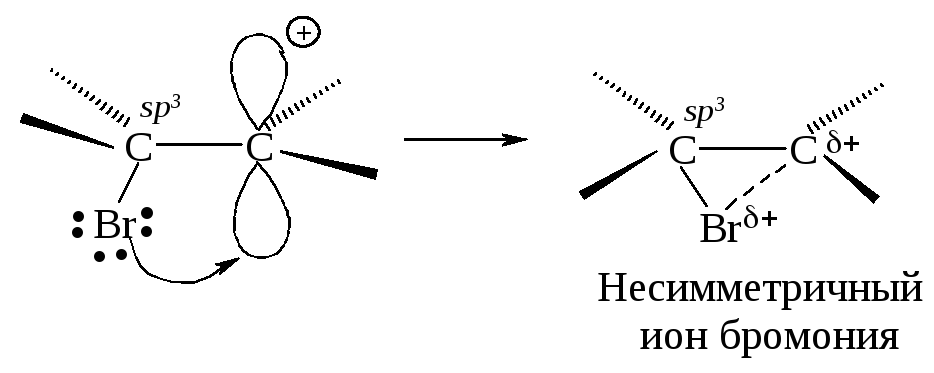
Третья стадия. Оставшийся анион брома (нуклеофил - ядро любящий) атакует образовавшийся циклический ион бромония по второму атому углерода.
Энергетическая диаграмма бромирования этилена приведена на рис. 4.8.
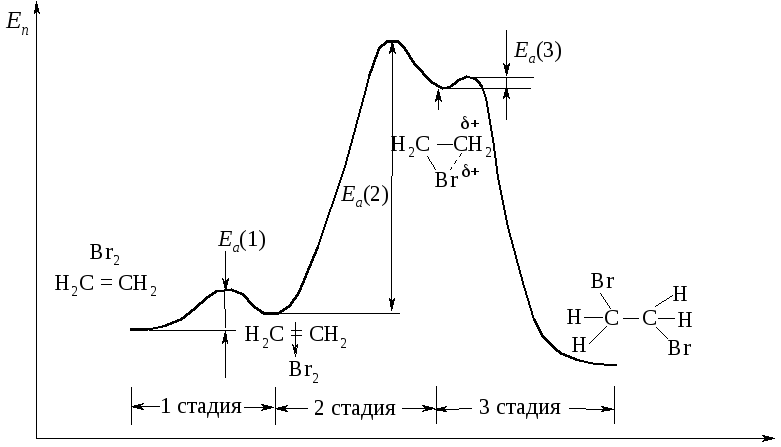
Рис. 4.8. Энергетическая диаграмма реакции бромирования этена
Стадия 2 – медленная, с высокой энергией активации
Доказательствами справедливости этого механизма служат следующие факты:
1). При проведении бромирования в растворе, содержащем помимо аниона брома другой нуклеофил (например, анион хлора), в продуктах реакции появляется наряду с дибромидом соединение, содержащее хлор.
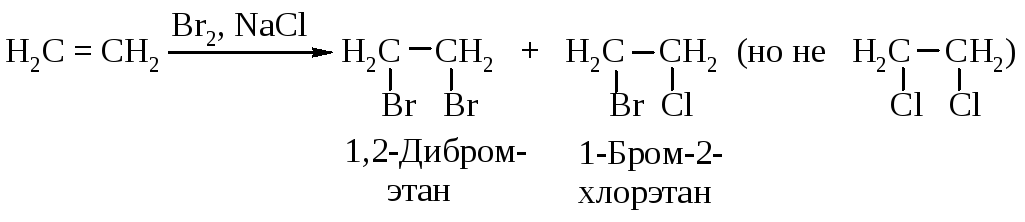
2). В соответствии со стадией 3 (рис. 4.8) электрофил - катион брома и нуклеофил - анион брома должны присоединяться к aлкeнy с противоположных сторон, т.е. в транс-положение.
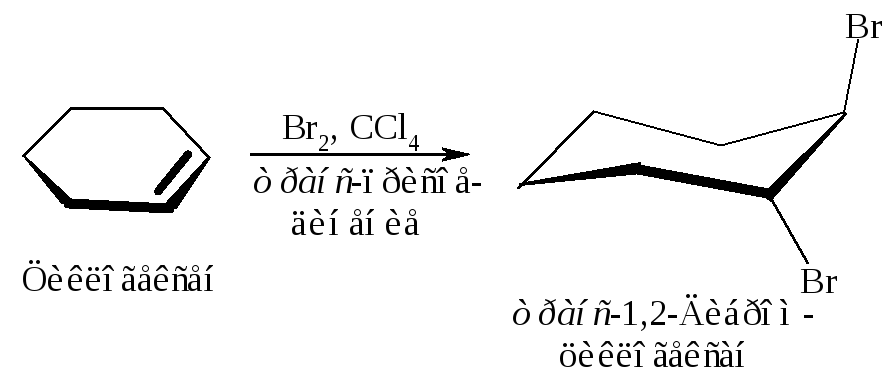
Присоединение брома к циклогексену действительно происходит в транс-положение.
4.4.3.2. Реакционная способность галогенов в реакции АdЕ
Присоединение хлора и брома к алкенам происходит легко и во многих случаях с количественным выходом. Присоединение йода к алкенам осуществить не удается. Взаимодействие фтора с алкенами происходит так энергично, что углеводород распадается на осколки с меньшим числом атомов углерода.
4.4.4. Присоединение галогеноводородов
Присоединение галогеноводородов к алкенам можно представить следующей схемой
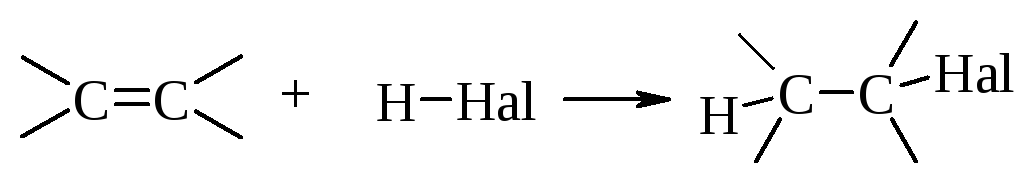
4.4.4.1. Механизм реакции
![]()
Алкены реагируют с хлористым, бромистым (в отсутствие пероксидов) или йодистым водородом по механизму электрофильного присоединения. Реакцию проводят, пропуская газообразный галогеноводород непосредственно в алкен, используя растворитель, который растворяет и неполярный алкен и полярный галогеноводород, например, ССl4.
Присоединение галогеноводорода протекает в две стадии.
Первая стадия. Присоединение электрофила - протона Н к алкену с образованием карбокатиона.
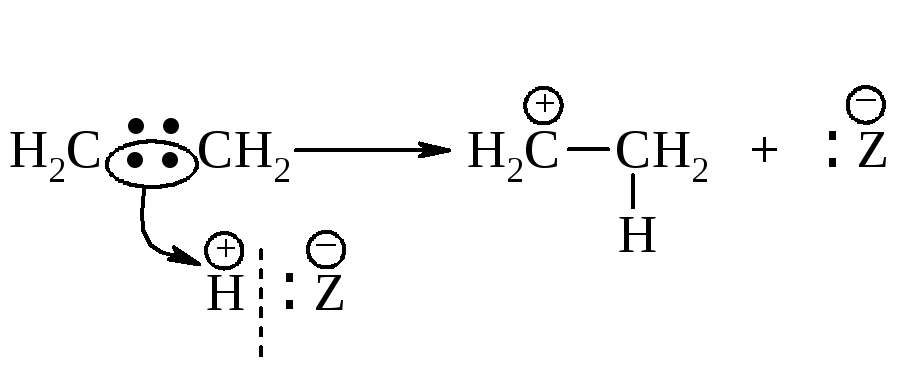
Вторая стадия. Взаимодействие нуклеофила Z– с карбокатионом.
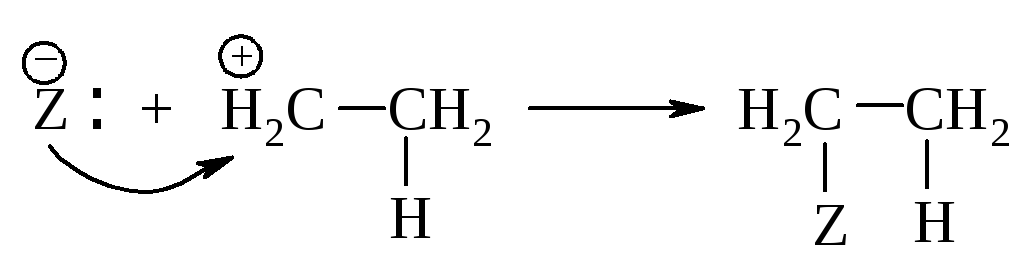
Медленной стадией является первая - присоединение электрофила с образованием карбокатиона. Она определяет общую скорость присоединения и тип реакции - электрофильное присоединение.
Порядок увеличения реакционной способности галогеноводородов по отношению к алкенам совпадает с порядком увеличения их кислотности: HF << HCI < HBr < HI. Это еще раз подтверждает положение о том, что лимитирующей стадией является атака двойной связи протоном.
