
- •А.Е. Бурученко
- •Часть 1
- •Введение
- •I. Физические основы механики
- •Кинематика
- •1.1. Модели в механике. Система отсчета. Траектория, длина пути, вектор перемещения
- •1.2. Скорость
- •1.3. Ускорение и его составляющие
- •1.4 Угловая скорость и угловое ускорение
- •2. Динамика материальной точки и поступательного движения твердого тела
- •2.1. Первый закон Ньютона. Масса. Сила
- •2.2. Второй закон Ньютона
- •2.3. Третий закон Ньютона
- •2.4. Силы трения
- •2.5. Закон сохранения импульса. Центр масс
- •3. Работа и энергия
- •3.1. Энергия, работа, мощность
- •3.2. Кинетическая и потенциальная энергии
- •3.3. Закон сохранения энергии
- •3.4. Графическое представление энергии
- •3.5. Удар абсолютно упругих и неупругих тел
- •Механика твердого тела
- •4.1. Момент инерции
- •4.2. Кинетическая энергия вращения
- •4.3. Момент силы. Уравнение динамики вращательного движения твердого тела
- •4.4. Момент импульса и закон его сохранения
- •4.5. Сила тяжести и вес. Невесомость
- •Механические колебания
- •5.1. Гармонические колебания и их характеристики
- •5.2. Механические гармонические колебания
- •5.3. Гармонический осциллятор. Пружинный, физический и математический маятники
- •5.4. Сложение гармонических колебаний одного направления и одинаковой частоты. Биения
- •5.5. Сложение взаимно перпендикулярных колебаний
- •5.6. Свободные затухающие колебания. Дифференциальное уравнение свободных затухающих колебаний. Автоколебания.
- •5.7. Вынужденне колебания. Дифференциальное уравнение вынужденных колебаний и его решение.
- •5.8. Амплитуда и фаза вынужденных колебаний. Резонанс
- •6. Элементы механики жидкостей
- •6.1. Давление в жидкости и газе
- •6.2. Уравнение неразрывности
- •6.3. Уравнение Бернулли и следствия из него
- •6.4. Вязкость (внутреннее трение). Ламинарный и турбулентный режимы течения жидкостей
- •Таким образом, модуль силы внутреннего трения
- •7. Элементы специальной теории относительности
- •7.1. Преобразования Галилея. Механический принцип относительности
- •Ускорение в системе отсчета к
- •7.2. Постулаты специальной теории относительности
- •7.3. Преобразования Лоренца
- •7.4. Следствия из преобразований Лоренца
- •Подставляя (7.10) в (7.9), получим
- •7.5. Интервал между событиями
- •7.6. Основной закон релятивистской динамики материальной точки
- •7.7. Законы взаимосвязи массы и энергии
- •Закон (7.26) можно, учитывая выражение (7.23), записать в виде
- •Энергия связи системы
- •II. Основы молекулярной физики и термодинамики
- •1. Молекулярно-кинетическая теория идеального газа
- •1.1. Опытные законы идеального газа
- •1.2. Уравнение Клапейрона-Менделеева
- •1.3. Основное уравнение молекулярно-кинетической теории идеальных газов
- •Тогда давление газа, оказываемое им на стенку сосуда
- •Уравнение (1.11) с учетом (1.12) примет
- •1.4. Закон Максвелла для распределения молекул идеального газа по скоростям
- •1.5. Среднее число столкновений и средняя длина свободного пробега молекул
- •Расчеты показывают, что при учете движения других молекул
- •Тогда средняя длина свободного пробега
- •1.6. Явления переноса в термодинамически неравновесных системах
- •Можно показать, что
- •2. Основы термодинамики
- •2.1. Число степеней свободы молекулы. Закон равномерного распределения энергии по степеням свободы молекул
- •2.2. Первое начало термодинамики
- •2.3. Работа газа при изменении его объема
- •2.4. Теплоемкость
- •2.5. Применение первого начала термодинамики к изопроцессам
- •Тогда для произвольной массы газа получим
- •2.6. Адиабатический процесс. Политропный процесс
- •2.7. Круговой процесс (цикл). Обратимые и необратимые процессы
- •2.8. Энтропия. Ее статистическое толкование и связь с термодинамической вероятностью
- •2.9. Второе начало термодинамики
- •2.10 Тепловые двигатели и холодильные машины. Цикл Карно и его коэффициент полезного действия для идеального газа
- •Оглавление
- •Часть 1
1.3. Основное уравнение молекулярно-кинетической теории идеальных газов
Для вывода основного уравнения молекулярно-кинетической теории рассмотрим одноатомный идеальный газ. Предположим, что молекулы газа движутся хаотически, число взаимных столкновений между ними пренебрежимо мало по сравнению с числом ударов о стенки сосуда, а соударения молекул со стенками сосуда абсолютно упругие. Выделим на стенке сосуда некоторую элементарную площадку S (рис.50) и вычислим давление, оказываемое на эту площадку.
|
Рис. 50 |
При
каждом соударении молекула, движущаяся
перпендикулярно площадке, передает
ей импульс m0 |
За
время t
площадки S
достигнут только те молекулы, которые
заключены в объеме цилиндра с основанием
S
и высотой
![]() t
(рис. 50).
t
(рис. 50).
Число
этих молекул равно nS![]() t
(n-концентрация
молекул). Необходимо, однако, учитывать,
что реально молекулы движутся к площадке
S
под разными углами и имеют различные
скорости, причем скорость молекул при
каждом соударении меняется. Для упрощения
расчетов хаотическое движение молекул
заменяют движением вдоль трех взаимно
перпендикулярных направлений, так что
в любой момент времени вдоль каждого
из них движется 1/3 молекул, причем
половина (1/6) движется вдоль данного
направления в одну сторону, половина-
в противоположную. Тогда число ударов
молекул, движущихся в заданном направлении,
о площадку S
будет 1/6nS
t
(n-концентрация
молекул). Необходимо, однако, учитывать,
что реально молекулы движутся к площадке
S
под разными углами и имеют различные
скорости, причем скорость молекул при
каждом соударении меняется. Для упрощения
расчетов хаотическое движение молекул
заменяют движением вдоль трех взаимно
перпендикулярных направлений, так что
в любой момент времени вдоль каждого
из них движется 1/3 молекул, причем
половина (1/6) движется вдоль данного
направления в одну сторону, половина-
в противоположную. Тогда число ударов
молекул, движущихся в заданном направлении,
о площадку S
будет 1/6nS![]() t.
При столкновении с площадкой эти молекулы
передадут ей импульс
t.
При столкновении с площадкой эти молекулы
передадут ей импульс
![]() .
.
Тогда давление газа, оказываемое им на стенку сосуда
![]() .
(1.11)
Если газ в объеме V содержит
N молекул, движущихся со скоростями
.
(1.11)
Если газ в объеме V содержит
N молекул, движущихся со скоростями
![]() ,
то целесообразно рассматривать среднюю
квадратичную скорость
,
то целесообразно рассматривать среднюю
квадратичную скорость
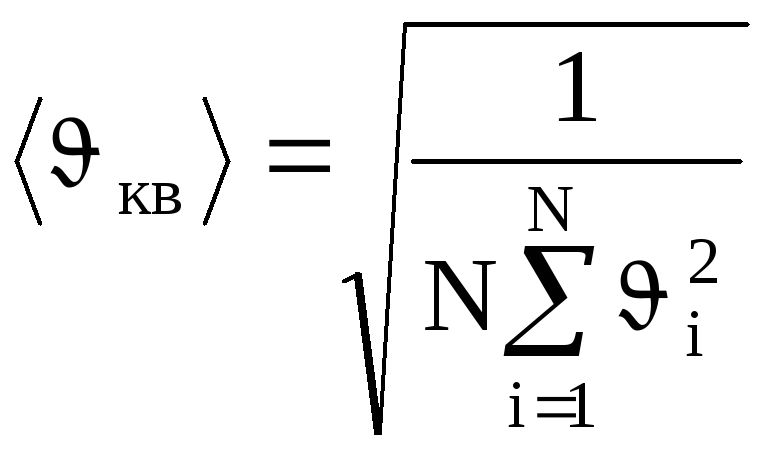 ,
(1.12)
,
(1.12)
характеризующую всю совокупность молекул газа.
Уравнение (1.11) с учетом (1.12) примет
![]() .
(1.13)
.
(1.13)
Выражение
(1.13) называется основным
уравнением
молекулярно-кинетической
теории
идеальных
газов. Точный
расчет с учетом движения молекул по
всевозможным направлениям дает ту же
формулу.
Учитывая, что
![]() ,
получим
,
получим
![]() (1.14)
или
(1.14)
или
![]() ,
0.15)
где Е - суммарная кинетическая
энергия поступательного движения всех
молекул газа.
,
0.15)
где Е - суммарная кинетическая
энергия поступательного движения всех
молекул газа.
Так как масса газа m=Nm0, то уравнение (1.14) можно переписать в виде
![]() .
.
Для одного моля газа m=M (M - молярная масса), поэтому
![]() ,
,
где Vm - молярный объем. С другой стороны, по уравнению Клапейрона-Менде-леева, pVm = RT. Таким образом,
![]() ,
,
откуда
![]() .
(1.16)
Так
как М=m0NA,
где m0
- масса одной молекулы, NA
- постоянная Авогадро, то из уравнения
(1.16) следует, что
.
(1.16)
Так
как М=m0NA,
где m0
- масса одной молекулы, NA
- постоянная Авогадро, то из уравнения
(1.16) следует, что
![]() ,
(1.17)
где
,
(1.17)
где
![]() - постоянная Больцмана. Отсюда найдем,
что при комнатной температуре молекулы
кислорода имеют среднюю квадратичную
скорость 480 м/с, водорода - 1900 м/с. При
температуре жидкого гелия те же скорости
будут соответственно 40 и 160 м/с.
- постоянная Больцмана. Отсюда найдем,
что при комнатной температуре молекулы
кислорода имеют среднюю квадратичную
скорость 480 м/с, водорода - 1900 м/с. При
температуре жидкого гелия те же скорости
будут соответственно 40 и 160 м/с.
Средняя кинетическая энергия поступательного движения одной молекулы идеального газа
![]() (1.18)
пропорциональна
термодинамической температуре и зависит
только от нее. Из этого уравнения следует,
что при Т=0
(1.18)
пропорциональна
термодинамической температуре и зависит
только от нее. Из этого уравнения следует,
что при Т=0
![]() =0,
т.е. при 0° К прекращается поступательное
движение молекул газа, а следовательно,
его давление равно нулю. Таким образом,
термодинамическая температура является
мерой средней кинетической энергии
поступательного движения молекул
идеального газами формула (1.18) раскрывает
молекулярно-кинетическое толкование
температуры.
=0,
т.е. при 0° К прекращается поступательное
движение молекул газа, а следовательно,
его давление равно нулю. Таким образом,
термодинамическая температура является
мерой средней кинетической энергии
поступательного движения молекул
идеального газами формула (1.18) раскрывает
молекулярно-кинетическое толкование
температуры.

