
- •Аннотация
- •Введение
- •Модуль 1. Цитология как наука работа № 1
- •1.1. Правила по технике безопасности
- •1.2. Правила оформления работ
- •1.3. Правила работы с микроскопом
- •1.4. Меры безопасности при работе с микроскопом
- •1.5. Устройство микроскопа
- •1.6. Настройка освещения микроскопа
- •1.6.1. С вынесенным осветителем
- •1.6.2. С встроенным в основание осветителем
- •1.7. Приготовление постоянных и временных препаратов
- •Работа № 2.
- •2.1. Важнейшие характеристики микроскопа
- •2.2. Разрешающая способность
- •2.3. Числовая апертура
- •2.4. Общее увеличение микроскопа
- •2.5. Глубина резкости изображения
- •Задание 1. Определение зависимости т и d от длины волны
- •Модуль 2. Клетка работа № 3
- •3.1. Общий план строения растительной и животной клеток
- •Задание 1. Эндоцитоз
- •Задание 2. Клетки плоского эпителия полости рта человека
- •Задание 3. Межклеточные соединения
- •Задание 4. Плазмодесмы в оболочках клеток запасающей ткани семени хурмы (Diospyros Kaki Thunb.)
- •Задание 5. Гранулярный эндоплазматический ретикулум
- •Задание 6. Аппарат Гольджи
- •Задание 7. Лизосомы
- •Задание 8. Пероксисомы
- •Задание 9. Строение клеток развивающихся листьев элодеи канадской (Elodea canadensis Michx.)
- •Задание 10. Клетки кожицы листа валлиснерии (Vallisneria spiralis l.)
- •Задание 11. Плазмолиз в клетках кожицы чешуи луковицы репчатого лука (Аlliит сера l.)
- •Задание 12. Строение клеток сформированного листа элодеи
- •Работа № 4.
- •Задание 1. Ультраструктурная организация митохондрий
- •Задание 2. Ультраструктурная организация хлоропласта.
- •Задание 3. Обнаружение ассимиляционного крахмала в клетках листа элодеи (Elodea canadensis Mich.)
- •Задание 4. Ультраструктурная организация хромопласта.
- •Задание 5. Хромопласты в клетках околоплодников зрелых плодов и корнеплодах моркови.
- •Задание 6. Ультраструктурная организация лейкопласта.
- •Задание 7. Лейкопласты в клетках кожици листа традесканции вирджинской (Tradescantia virginiana l.)
- •Задание 8. Микрофотография амилопласта.
- •Задание 9. Микрофотография гранулярного эндоплазматического ретикулума
- •Задание 9. Микрофотографии молодой растительной клетки
- •Работа № 5.
- •Задание 5. Митоз в клетках корешка лука
- •Задание 6. Митоз в животной клетке
- •Задание 7. Амитоз эпителиальных клеток
- •Модуль 3. Основы гистологии работа № 6
- •Задание 1. Клетки плоского эпителия полости рта человека
- •Задание 2. Клетки призматического эпителия почечных канальцев
- •Задание 3. Клетки мерцательного эпителия мантии беззубки
- •Задание 4. Многорядный однослойный эпителий
- •Задание 5. Многослойный эпителий
- •Задание 6. Переходный эпителий мочевого пузыря
- •Задание 7. Обкладочные клетки фундальных желез желудка
- •Задание 8. Рыхлая соединительная ткань крысы
- •Задание 9. Жировая ткань
- •Задание 11. Пигментные клетки кожи головастика
- •Меланофоры встречаются в эпидермисе и соединительной ткани кожи, в сосудистых оболочках и сетчатке глаза, а так же в некоторых внутренних органах человека и животных.
- •Задание 1. Гиалиновый хрящ ребра кролика.
- •Задание 2. Волокнистый хрящ межпозвоночного диска
- •Задание 3. Эластическая связка. Продольный разрез
- •Задание 4. Плотная коллагеновая соединительная ткань. Сухожилие, продольный разрез
- •Задание 5. Плотная коллагеновая соединительная ткань. Сухожилие, поперечный разрез
- •Задание 6. Костная ткань. Клетки жаберной крышки
- •Задание 7. Берцовая кость человека в поперечном разрезе.
- •Задание 8. Развитие кости из соединительной ткани. Нижняя челюсть зародыша свиньи.
- •Задание 9. Развитие кости на месте хряща. Трубчатая кость зародыша свиньи
- •Задание 10. Эритроциты лягушки
- •Задание 11. Мазок крови человека
- •Работа № 8
- •Задание 1. Поперечнополосатая мышечная ткань
- •Задание 2. Гладкая мышечная ткань
- •Задание 3. Сердечная мышечная ткань
- •Задание 4. Нервные клетки сетчатки лошади
- •Задание 5. Двигательные нейроны. Спинной мозг
- •Задание 6. Тигроид в двигательных нейронах
- •Задание 7. Синапсы на нейронах мозжечка
- •Задание 8. Миелиновые нервные волокна
- •Список литературы
- •Заключение
Задание 2. Ультраструктурная организация хлоропласта.
Рассмотреть микрофотографии (рис.5-27, 5-28, 5-30, с. 56-58, Атлас по биологии клетки, 1978; рис. 114, с. 200, Ченцов, 1988) и зарисовать внутреннее строение хлоропласта. Обозначить на рисунке наружную мембрану, строму, внутреннюю мембрану, зерна крахмала, граны, тилакоиды гран.
Задание 3. Обнаружение ассимиляционного крахмала в клетках листа элодеи (Elodea canadensis Mich.)
П ри
хороших условиях освещения в хлоропластах
происходит активный фотосинтез и
образуется большое количество
ассимиляционного
крахмала, который можно выявить с помощью
йодной реакции.
Для этого свежий лист элодеи, предварительно
выдержанный
на свету, кладут в раствор йода в водном
растворе йодида
калия, накрывают покровным стеклом и
рассматривают при большом увеличении
микроскопа. Так как этот реактив убивает
клетку, хлоропласты выглядят несколько
разбухшими по сравнению
с пластидами живой клетки. Внутри
хлоропластов можно
заметить зерна ассимиляционного крахмала
(рис. 12), которые
от йода приобретают темно-синий или
темно-фиолетовый цвет,
а белковая строма, окружающая крахмал,
становится бурой.
ри
хороших условиях освещения в хлоропластах
происходит активный фотосинтез и
образуется большое количество
ассимиляционного
крахмала, который можно выявить с помощью
йодной реакции.
Для этого свежий лист элодеи, предварительно
выдержанный
на свету, кладут в раствор йода в водном
растворе йодида
калия, накрывают покровным стеклом и
рассматривают при большом увеличении
микроскопа. Так как этот реактив убивает
клетку, хлоропласты выглядят несколько
разбухшими по сравнению
с пластидами живой клетки. Внутри
хлоропластов можно
заметить зерна ассимиляционного крахмала
(рис. 12), которые
от йода приобретают темно-синий или
темно-фиолетовый цвет,
а белковая строма, окружающая крахмал,
становится бурой.
-
Рис. 12. Ассимиляционный крахмал в клетках листа элодеи: 1 — хлоропласты с ассимиляционным крахмалом; 2 — хлоропласты; 3 — оболочка клетки.
Задание 4. Ультраструктурная организация хромопласта.
Рассмотреть микрофотографии (рис. 120, с. 208, Ченцов, 1988) и зарисовать внутреннее строение хромопласта. Обозначить на рисунке наружную мембрану, строму, внутреннюю мембрану, зерна крахмала, кристаллы каротина.
Задание 5. Хромопласты в клетках околоплодников зрелых плодов и корнеплодах моркови.
Для изучения пригодны ягоды ландыша, плоды рябины, шиповника, кизильника, томатов, паслена и других растений (рис.13).
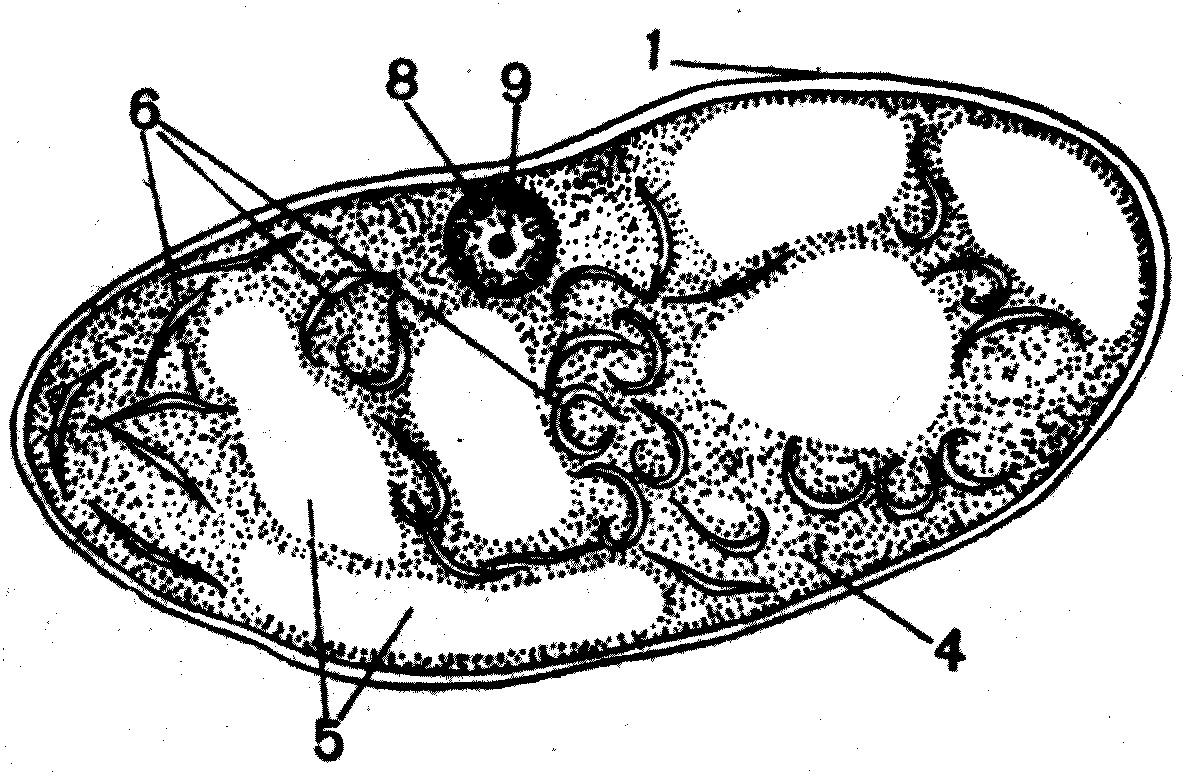
Рис.13. Хромопласты в клетках кизильника черноплодного. 1 – оболочка клетки; 4 – цитоплазма; 5 – вакуоль; 6 - хромопласты; 8 – ядро; 9 – ядрышко.
Небольшой кусочек мякоти зрелого плода переносят препаровальной иглой в каплю воды на предметное стекло, слегка размешивают, чтобы на препарате не было комков, накрывают покровным стеклом и рассматривают при малом и большом увеличении микроскопа.
Созревание плодов обычно сопровождается разъединением клеток вследствие растворения находящихся между ними пектиновых веществ. Этот процесс называют мацерацией. Мацерированные клетки околоплодников имеют округлые, овальные или слегка угловатые очертания. Клетки очень тонкостенные, поэтому при приготовлении препарата покровное стекло надо опускать осторожно, чтобы на оболочках не образовались складки. Клетки богаты клеточным соком, однако границы между цитоплазмой и вакуолями, как правило, не видны.
В цитоплазму погружены многочисленные желтые пластиды - хромопласты. Если в клетке видно ядро, то пластиды преимущественно локализуются вокруг него (рис. 13).
У разных растений пластиды различаются размерами и формой. У ландыша (Convallaria majalis L.), паслена (Solatium dulcamara L.) и в некоторых клетках шиповника (Rosa) хромопласты по форме почти не отличаются от хлоропластов, из которых они образовались. У рябины (Sorbus aucuparia L.) они игольчатые. Наиболее причудливые очертания характерны для хромопластов черноплодного кизильника (Cotoneaster melanocarpus Fisch, exBlytt). У этих растений при формировании хромопласта происходит кристаллизация каротина и образовавшиеся кристаллы растягивают строму пластиды. В клетках томатов (Lycopersicon esculentum Mill.) наряду с пластидами, имеющими более или менее округлые очертания и содержащими небольшие кристаллы, встречаются и одиночные, видимо, не окруженные стромой довольно крупные кристаллы каротина.
Очень сильная кристаллизация каротина, который накапливается в лейкопластах, происходит в клетках корнеплодов моркови (Daucus carota L.), которые следует рассматривать на тонких поперечных или продольных срезах. Кристаллы обычно свободно лежат в цитоплазме клеток.
