
- •Частина і
- •Частина і
- •1. Класифікація неорганічних сполук
- •1.1. Оксиди
- •Гідроксиди
- •2. Приклади розв’язання типових задач з теми 1
- •3. Основні поняття та закони хімії. Атомно-молекулярне вчення Програмні питання
- •3.1. Основні поняття та закони хімії
- •3.2. Запитання для самостійної підготовки
- •Приклади розв’язання типових задач з теми 3
- •Будова атома. Періодичний закон і періодична система д. І. Менделєєва
- •5.1. Будова атома
- •Основні характеристики елементарних частинок
- •5.2. Періодичний закон і періодична система д. І. Менделєєва
- •5.3. Запитання для самостійної підготовки
- •Приклади розв’язання типових завдань з теми 5
- •Набір квантових чисел для електронів, які характеризуються станом 4d7
- •Набір квантових чисел для атома з електронною конфігурацією 1s22s22p63s23р2
- •2P; 3s; 3d; 4p; 5s; 4d; 6s; 4f (табл. 6.3).
- •Розрахунок енергій ао за правилами Клечковського
- •7. Хімічний зв’язок. Будова молекул. Кристалічний стан речовини
- •7.1. Ковалентний хімічний зв’язок
- •Будова молекул
- •7.3. Іонний та металічний хімічні зв’язки. Міжмолекулярна взаємодія
- •Кристалічний стан речовини
- •Запитання для самостійної підготовки
- •Приклади розв’язання типових завдань з теми 7
- •Валентність Брому і за електронною конфігурацією
- •Елементи хімічної термодинаміки Програмні питання
- •9.1. Короткі теоретичні відомості
- •9.2. Запитання для самостійної підготовки
- •10. Приклади розв’язання типових задач
- •32 Г сірки (1 моль) виділяється 296,9 кДж;
- •Вплив температури на можливість перебігу хімічних процесів
- •11. Хімічна кінетика і хімічна рівновага Програмні питання
- •11.1. Кінетика хімічних процесів
- •11.2. Рівноважні процеси
- •Константа рівноваги
- •11.3. Запитання для самостійної підготовки
- •12. Приклади розв’язання типових задач з теми 11
- •За формулою (9.4) розраховуємо зміну вільної енергії Гіббса у хімічній реакції
- •13. Розчини. Загальні властивості розчинів неелектролітів Програмні питання
- •Властивості розчинів неелектролітів
- •13.3. Запитання для самостійної підготовки
- •Приклади розв’язання типових задач з теми 13
- •Тиск насиченої пари над розчином розраховуємо за формулою:
- •15. Розчини електролітів
- •15.1. Електролітична дисоціація у розчинах електролітів
- •15.2. Особливості розчинів електролітів
- •15.3. Напрям перебігу процесів у розчинах електролітів. Іонно-молекулярні рівняння
- •Тобто реакція зліва направо не перебігає. Слід пам’ятати, що серед основ сильними електролітами є тільки основи лужних та лужно-земельних металів:
- •15.4. Електролітична дисоціація води. Водневий показник рН
- •15.5. Добуток розчинності
- •15.6. Гідроліз солей
- •У молекулярному вигляді:
- •15.7. Запитання для самостійної підготовки
- •16. Приклади розв’язання типових задач
- •Використовуючи формулу (13.7), знаходимо ізотонічний коефіцієнт
- •Стандартні ентальпії утворення , ентропії та енергії Гіббса утворення деяких речовин при 298 к
- •Інтегральні теплоти розчинення деяких речовин у воді
- •Список рекомендованої та додаткової літератури
Використовуючи формулу (13.7), знаходимо ізотонічний коефіцієнт
(![]() =
=
![]() ):
):
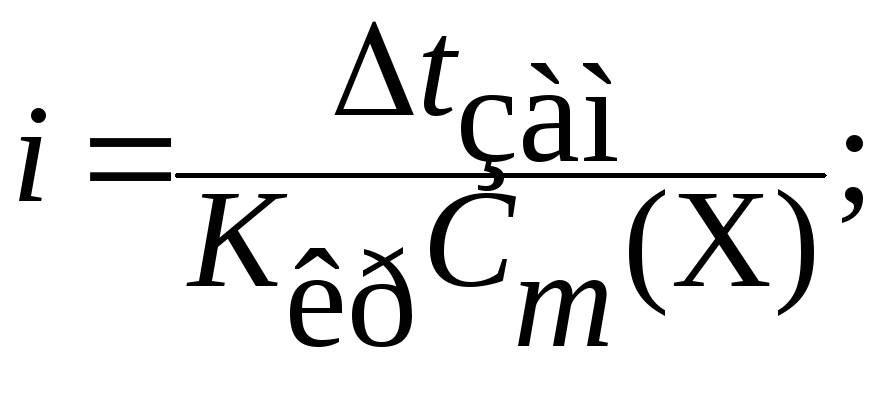
![]()
За допомогою рівняння (13.6) знаходимо кількість іонів, що утворюються внаслідок дисоціації електроліту:
![]()
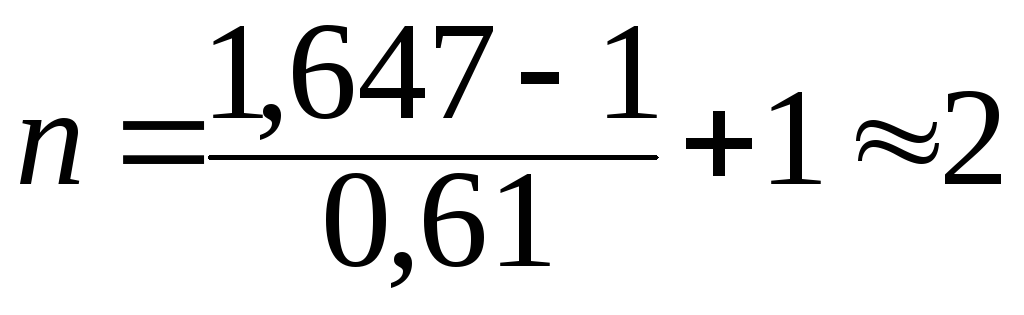 (іони)
(іони)
Таким чином, молекула даного електроліту дисоціює у воді з утворенням двох іонів.
Задача 5. Обчислити ступінь дисоціації та концентрацію іонів Н+ у розчині хлорнуватистої кислоти НClО з концентрацією 0,01 моль/л. Константа дисоціації кислоти KД = 5,8 108. Як зміниться концентрація іонів Н+, якщо до 1 л вихідного розчину кислоти додати 0,02 моль NaClО?
Розв’язання. Хлорнуватиста кислота – слабкий електроліт, який у водному розчині дисоціює на іони згідно зі схемою
НClО![]() Н+
+ ClО.
Н+
+ ClО.
Ступінь дисоціації кислоти 1, тому використовуємо спрощену формулу закону Оствальда:
KД = 2 С(Х),
де
= [H+]/C(Х).
У свою чергу,
[H+]
=
![]() ;
;
[H+]
=
![]() =
2,41
105
(моль/л);
=
2,41
105
(моль/л);
= 2,41 105/0,01 = 2,44 103.
Ступінь дисоціації слабкого електроліту сильно зменшується, якщо до розчину додати сильний електроліт з однойменним іоном. У цьому випадку під час дисоціації NaClО ( = 1) утворюються однойменні ClО-іони:
N aClО
Na+
+ ClО.
aClО
Na+
+ ClО.
Тому у розчині збільшується концентрація іонів ClО і, відповідно, зменшується концентрація іонів Н+. Це обумовлено зміщенням рівноваги (формула (15.13)) вліво – у напрямі процесу моляризації.
Позначимо нову концентрацію іонів Н+ через х (тобто С(Н+) = х), тоді концентрація іонів СlО дорівнюватиме х + С(СlО), де С(СlО) – концентрація іонів СlО, що утворилися дисоціацією сильного електроліту NaClО:
С(СlО)
= С(NaClО)
=
![]() ;
;
С(СlО) = 0,02 / 1 = 0,02 (моль/л).
Константа рівноваги процесу дисоціації кислоти (константа дисоціації) має вигляд
![]() .
.
Через те, що хлорнуватиста кислота дуже слабкий електроліт, можна припустити, що рівноважна концентрація кислоти [HClO] близька до вихідної молярної концентрації: [HClO] С(HClO).
Тоді
![]() ;
;
х2 + 0,02х = 5,8 1010.
Оскільки величина х2 достатньо мала, нею можна знехтувати, тоді
0,02х 5,8 1010
х 2,9 108.
Отже,
С(Н+) = 2,9 108 моль/л.
Таким чином, концентрація іонів водню зменшиться приблизно в
![]()
Задача 5. Розрахуйте рН та рОН водних розчинів: а) нітратної кислоти з молярною концентрацією 0,001 моль/л; б) гідроксиду калію з молярною концентрацією 0,01 моль/л.
Розв’язання:
а) нітратну кислоту вважають сильним електролітом ( = 1), тому схему її дисоціації можна подати у вигляді
HNO3 = H+ + NO3.
Концентрація іонів H+ та NO3 у розчині сильного електроліту дорівнює молярній концентрації кислоти, тому
[H+] = [NO3] = C(HNO3) = 0,001 моль/л.
Тоді
рН = lg 0,001 = 3;
рОН = 14 3 = 11.
б) гідроксид калію також є сильним електролітом ( = 1), тому схема його дисоціації
KOH = K+ + OH.
Концентрації іонів K+ та ОН у розчині цього сильного електроліту дорівнюють його молярній концентрації:
[OH] = [K+] = C(KOH) = 0,01 моль/л.
Тоді розраховуємо рОН розчину за формулою (15.9):
pОH = lg [ОH];
pОH = lg 0,01 = 2;
рН = 14 2 = 12.
Задача 6. Розрахуйте рН та рОН водного розчину мурашиної кислоти НСООН з масовою часткою 0,05 (густина розчину 1000 г/дм3), якщо константа дисоціації мурашиної кислоти дорівнює 2,1 · 104.
Розв’язання. Мурашину кислоту відносять до слабких електролітів, тобто вона частково дисоціює за схемою
НСООН![]() Н+
+ СОО.
Н+
+ СОО.
Масову частку розчиненої речовини розраховуємо за формулою (13.8):
![]() ,
,
тобто маса мурашиної кислоти, що міститься в 1 л розчину:
m(HCOOH) = mрозч (НСООН) = Vрозч dрозч (НСООН);
m(HCOOH) = 1 1000 0,05 = 50 г.
Молярна концентрація розчину кислоти:
С(НСООН)
=
![]() ;
;
М(НСООН) = 46 г/моль;
С(НСООН)
=
![]() моль/л.
моль/л.
Оскільки НСООН 1, її константу дисоціації можна визначити за спрощеною формулою закону Оствальда:
KД
=
![]() С(НСООН).
С(НСООН).
У свою чергу,
НСООН = [H+]/C(HCOOH),
де [H+] концентрація іонів H+ у розчині мурашиної кислоти, моль/л.
Тоді
[H+]
=
![]() ;
;
[H+]
=
![]() = 1,51
102
моль/л.
= 1,51
102
моль/л.
Розраховуємо рН розчину за формулою (15.2):
pH = lg [H+];
pH = lg(1,51 102) = 1,82.
Оскільки
рН + рОН = 14, то
рОН = 14 рН = 14 1,82 = 12,18.
Задача
7.
Концентрація насиченого при 20 С
водного розчину H2S
дорівнює 0,1 моль/л. Обчисліть рівноважні
концентрації іонів [H+],
[HS],
[S2].
Константи дисоціації кислоти
![]()
Розв’язання. Сірководнева кислота є слабким електролітом, вона ступенево дисоціює за схемами:
H2S![]() H+
+ HS
(
H+
+ HS
(![]() );
);
HS
![]() H+
+ S2
(
H+
+ S2
(![]() ).
).
Оскільки
![]() ,
дисоціацією за другим ступенем можна
знехтувати.
,
дисоціацією за другим ступенем можна
знехтувати.
Тоді
[H+]
[HS]
=
![]() ;
;
[H+]
[HS]
=
![]() =
7,75
105
моль/л.
=
7,75
105
моль/л.
Для приблизного розрахунку [S2] використовуємо вираз
![]() .
.
Враховуючи,
що [H+]
[HS]
, [S2]
![]() = 1
1014
моль/л.
= 1
1014
моль/л.
Отже,
[H+] = 7,75 105 моль/л;
[HS] = 7,75 105 моль/л;
[S2] = 1 1014 моль/л.
Задача 8. За якої молярної концентрації оцтової кислоти у водному розчині її ступінь дисоціації дорівнює 0,01? Константа дисоціації оцтової кислоти дорівнює 1,8 105.
Розв’язання. Оцтова кислота – слабкий електроліт, що частково дисоціює на іони:
СН3CООН![]() СН3CОО
+ Н+.
СН3CОО
+ Н+.
онстанту дисоціації кислоти можна розрахувати за спрощеною формулою закону Оствальда: KД 2 С,
С(СН3CООН) = 1,8 105/0,012 = 0,18 моль/л.
Задача 9. Скільки грамів KOH міститься в 10 л розчину, рН якого дорівнює 11?
Розв’язання. KOH – луг, сильний електроліт ( = 1), який у водному розчині повністю дисоціює на іони:
 KOH
K+
+ OH.
KOH
K+
+ OH.
Для сильних електролітів концентрація іонів дорівнює молярній концентрації розчиненої речовини, тобто
[OH] = [K+] = C(KOH).
Оскільки
рОН = 14 рН, рОН = 14 11 = 3, то
[OH] = 10рОН,
[OH] = 103 моль/л.
Тоді
C(KOH) = 0,001 моль/л.
Завдання 10. Напишіть у молекулярній та іонній формі рівняння реакцій і вказати сполуку, утворення якої визначає напрям перебігу процесу:
а
(NH3H2O)

 )
Pb(NO3)2
+ KI ; б) AlBr3
+ AgNO3
; в) FeCl3
+ NH4OH
;
)
Pb(NO3)2
+ KI ; б) AlBr3
+ AgNO3
; в) FeCl3
+ NH4OH
;
г )
NaHCO3
+ HNO3
.
)
NaHCO3
+ HNO3
.
Розв’язання:
а) Pb(NO3)2 + 2KI = PbI2 + 2KNO3,
P
сильний електроліт
сильний
електроліт
сильний
електроліт
Pb2+ + 2I = PbI2.
Оскільки внаслідок взаємодії утворюється поганорозчинний йодид свинцю,
рівновага у системі зміщується у напрямі прямої реакції.
б) AlBr3 + 3AgNO3 = 3AgBr + Al(NO3)3,
A
сильний електроліт
сильний
електроліт
сильний
електроліт
Взаємодія у процесі відбувається з утворенням малорозчинного броміду срібла:
Ag+ + Br = AgBr.
(NH3H2O)
F
сильний електроліт
слабкий
електроліт
сильний електроліт
Fe3+ + 3NH4OH = Fe(OH)3 + 3NH4+.
У цьому випадку взаємодія сильного електроліту FeCl3 та слабкого
NH3H2O NH4OH приводить до утворення осаду Fe(OH)3, тому рівновага зміщується у напрямі прямого процесу.
Н2СО3
N
сильний електроліт
сильний
електроліт
сильний
електроліт
малодисоційована
речовина
HCO3 + H+ = CO2 + Н2О.
Утворюється газоподібна речовина, тому рівновага у системі зміщується вправо.
Як можна простежити за цими прикладами, зміщення іонних рівноваг іде у напрямі, в якому найповніше відбувається зв’язування іонів, а концентрації вільних, незв’язаних іонів, що залишаються у розчині, стають мінімально можливими.
ДОДАТКИ
Додаток 1
Відносна електронегативність атомів
|
I |
II |
III |
IV |
V |
VI |
VII |
VIII |
||
|
H 2,1 |
|
|
|
|
|
|
|
|
|
|
Li 1,0 |
Be 1,5 |
B 2,0 |
C 2,5 |
N 3,0 |
O 3,5 |
F 4,0 |
|
|
|
|
Na 0,9 |
Mg 1,2 |
Al 1,5 |
Si 1,8 |
P 2,1 |
S 2,5 |
Cl 3,0 |
|
|
|
|
K 0,8 |
Ca 1,0 |
Sc 1,3 |
Ti 1,3 |
|
Cr 1,6 |
Mn 1,6 |
Fe 1,6 |
Co 1,7 |
Ni 1,8 |
|
|
Zn 1,6 |
Ga 1,6 |
Ge 2,0 |
As 2,0 |
Se 2,4 |
Br 2,8 |
|
|
|
|
Rb 0,8 |
Sr 1,0 |
Y 1,3 |
Zr 1,5 |
Nb 1,7 |
|
|
Ru 2,0 |
Rh 2,1 |
Pd 2,1 |
|
Ag 1,9 |
Cd 1,7 |
In 1,7 |
|
Sb 1,8 |
Te 2,1 |
I 2,6 |
|
|
|
|
Cs 0,75 |
Ba 0,9 |
La 1,2 |
Hf 1,4 |
|
|
|
Os 2,1 |
Ir 2,1 |
Pt 2,1 |
|
|
Hg 1,8 |
|
Pb 1,6 |
Bi 1,8 |
Po 2,3 |
At 2,2 |
|
|
|
|
Fr 0,7 |
Ra 0,9 |
|
|
|
|
|
|
|
|
Додаток 2
