
- •Частина і
- •Частина і
- •1. Класифікація неорганічних сполук
- •1.1. Оксиди
- •Гідроксиди
- •2. Приклади розв’язання типових задач з теми 1
- •3. Основні поняття та закони хімії. Атомно-молекулярне вчення Програмні питання
- •3.1. Основні поняття та закони хімії
- •3.2. Запитання для самостійної підготовки
- •Приклади розв’язання типових задач з теми 3
- •Будова атома. Періодичний закон і періодична система д. І. Менделєєва
- •5.1. Будова атома
- •Основні характеристики елементарних частинок
- •5.2. Періодичний закон і періодична система д. І. Менделєєва
- •5.3. Запитання для самостійної підготовки
- •Приклади розв’язання типових завдань з теми 5
- •Набір квантових чисел для електронів, які характеризуються станом 4d7
- •Набір квантових чисел для атома з електронною конфігурацією 1s22s22p63s23р2
- •2P; 3s; 3d; 4p; 5s; 4d; 6s; 4f (табл. 6.3).
- •Розрахунок енергій ао за правилами Клечковського
- •7. Хімічний зв’язок. Будова молекул. Кристалічний стан речовини
- •7.1. Ковалентний хімічний зв’язок
- •Будова молекул
- •7.3. Іонний та металічний хімічні зв’язки. Міжмолекулярна взаємодія
- •Кристалічний стан речовини
- •Запитання для самостійної підготовки
- •Приклади розв’язання типових завдань з теми 7
- •Валентність Брому і за електронною конфігурацією
- •Елементи хімічної термодинаміки Програмні питання
- •9.1. Короткі теоретичні відомості
- •9.2. Запитання для самостійної підготовки
- •10. Приклади розв’язання типових задач
- •32 Г сірки (1 моль) виділяється 296,9 кДж;
- •Вплив температури на можливість перебігу хімічних процесів
- •11. Хімічна кінетика і хімічна рівновага Програмні питання
- •11.1. Кінетика хімічних процесів
- •11.2. Рівноважні процеси
- •Константа рівноваги
- •11.3. Запитання для самостійної підготовки
- •12. Приклади розв’язання типових задач з теми 11
- •За формулою (9.4) розраховуємо зміну вільної енергії Гіббса у хімічній реакції
- •13. Розчини. Загальні властивості розчинів неелектролітів Програмні питання
- •Властивості розчинів неелектролітів
- •13.3. Запитання для самостійної підготовки
- •Приклади розв’язання типових задач з теми 13
- •Тиск насиченої пари над розчином розраховуємо за формулою:
- •15. Розчини електролітів
- •15.1. Електролітична дисоціація у розчинах електролітів
- •15.2. Особливості розчинів електролітів
- •15.3. Напрям перебігу процесів у розчинах електролітів. Іонно-молекулярні рівняння
- •Тобто реакція зліва направо не перебігає. Слід пам’ятати, що серед основ сильними електролітами є тільки основи лужних та лужно-земельних металів:
- •15.4. Електролітична дисоціація води. Водневий показник рН
- •15.5. Добуток розчинності
- •15.6. Гідроліз солей
- •У молекулярному вигляді:
- •15.7. Запитання для самостійної підготовки
- •16. Приклади розв’язання типових задач
- •Використовуючи формулу (13.7), знаходимо ізотонічний коефіцієнт
- •Стандартні ентальпії утворення , ентропії та енергії Гіббса утворення деяких речовин при 298 к
- •Інтегральні теплоти розчинення деяких речовин у воді
- •Список рекомендованої та додаткової літератури
15.6. Гідроліз солей
Гідроліз є окремим випадком процесу сольволізу – взаємодії розчиненої
речовини та розчинника.
Гідролізом солей називають обмінний процес взаємодії солі з водою, внас-лідок чого утворюються малорозчинні слабодисоційовані речовини або гази.
Можна зауважити, що гідроліз є процесом, оборотним реакції нейтралізації, тобто ендотермічним процесом.
Залежно від природи солі, що підлягає гідролізу, розрізняють декілька його типових випадків:
1. Сіль утворена сильною кислотою і сильною основою, наприклад:
NaCl
+ HOН![]() NaOH
+ HCl;
NaOH
+ HCl;
Na+
+ Cl
+ HOН![]() Na+
+ OH
+ H+
+ Cl;
Na+
+ OH
+ H+
+ Cl;
HOН![]() OH
+ H+
(pH = 7 – нейтральне
середовище).
OH
+ H+
(pH = 7 – нейтральне
середовище).
Отже, за звичайних умов гідролізу практично не підлягають солі, утворені сильними кислотами і сильними основами, а також солі, нерозчинні у воді.
2. Сіль утворена слабкою основою і сильною кислотою:
N
(NH3
·
H2O)
![]() NH4OH
+ HCl;
NH4OH
+ HCl;
NH4+
+
Cl
+ HOН![]() NH4OH
+ H+
+ Cl;
NH4OH
+ H+
+ Cl;
NH4+
+
HOН![]() NH4OH
+ H+.
NH4OH
+ H+.
Гідроліз солі відбувається “за катіоном”. Оскільки при гідролізі солі
утворюється надлишок катіонів Н+, реакція середовища кисла, тобто рН 7. Отже, реакцію середовища в результаті гідролізу можна визначити за сильнішим електролітом.
Процес гідролізу відбувається таким чином: NH4Cl сильний електроліт, який у водному розчині повністю дисоційований на іони:
N H4Cl
NH4+
+
Cl.
H4Cl
NH4+
+
Cl.
У свою чергу, йони NH4+ та Cl у воді гідратовані; тому гідролізу підлягає вже гідратований катіон амонію:
(NH3
·
H2O)





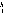
![]()
![]() NH4OH
+ Н+.
NH4OH
+ Н+.
Якщо сіль утворена багатокислотною основою, гідроліз солі відбувається ступіньчасто, зокрема:
Cu(NO3)2
+ HOH![]() (CuOH)NO3
+ HNO3;
(CuOH)NO3
+ HNO3;
Cu2+
+ 2NO3
+ HOH![]() CuOH+
+ NO3
+ H+
+ NO3.
CuOH+
+ NO3
+ H+
+ NO3.
І
ступінь: Cu2+
+ HOH![]() CuOH+
+ H+,
рН
7 (кисле середовище);
CuOH+
+ H+,
рН
7 (кисле середовище);
ІІ
ступінь: CuОН+
+ HOH![]() Cu(OH)2
+ H+,
рН
7.
Cu(OH)2
+ H+,
рН
7.
Як правило, гідроліз солей відбувається тільки за першим ступенем.
3. Сіль утворена сильною основою та слабкою кислотою:
С Н3СООK
СН3СОО
+ K+;
Н3СООK
СН3СОО
+ K+;
СН3СОО
+ НОН![]() СН3СООН
+ ОН.
СН3СООН
+ ОН.
Гідроліз даної солі відбувається “за аніоном”. Оскільки внаслідок гідролізу утворюється надлишок ОН, то реакція середовища лужна (рН 7).
Якщо сіль утворена багатоосновною кислотою, процес гідролізу солі відбуватиметься ступіньчасто, наприклад:
N a2CO3
2Na+
+
CO32.
a2CO3
2Na+
+
CO32.





 І
ступінь: CO32
+
І
ступінь: CO32
+
![]()
![]() HCO3
+ OH,
рН
7 (лужне середовище).
HCO3
+ OH,
рН
7 (лужне середовище).
У молекулярному вигляді:
Na2CO3
+ HOH![]() NaHCO3
+ NaOH;
NaHCO3
+ NaOH;
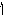



 ІІ
ступінь: НCO3
+
ІІ
ступінь: НCO3
+
![]()
![]() H2CO3
+ OH,
рН
7.
H2CO3
+ OH,
рН
7.
У молекулярному вигляді:
NaHCO3
+
НOH![]() H2CO3
+ NaOH.
H2CO3
+ NaOH.
Отже, якщо гідроліз такої солі відбувається тільки за першим ступенем, як продукти гідролізу утворюються кислі солі (NaHCO3 та ін.).
4. Сіль утворена слабкою основою і слабкою кислотою:
С Н3СООNH4
СН3СОО
+ NH4+;
Н3СООNH4
СН3СОО
+ NH4+;
С
(NH3
·
H2O)
![]() СН3СООН
+ NH4OH.
СН3СООН
+ NH4OH.
Оскільки Kд(NH4OH) = 1,78 105, а Kд(СН3СООН) = 1,78 105, то середовище можна вважати нейтральним (рН 7).
Розглянемо ступіньчастий гідроліз (солі утвореної багатокислотною основою):
в іонній формі:
І
ступінь: Al3+
+ 3СН3СОО
+ H2O![]() Al(OH)2+
+ 2СН3СОО
+ СН3СООН;
Al(OH)2+
+ 2СН3СОО
+ СН3СООН;
II
ступінь: Al(OH)2+
+ 2СН3СОО+
H2O![]() Al(OH)2+
+ СН3СОО
+
СН3СООН;
Al(OH)2+
+ СН3СОО
+
СН3СООН;
III
ступінь: Al(OH)2+
+ СН3СОО
+ H2O![]() Al(OH)3
+ СН3СООН;
Al(OH)3
+ СН3СООН;
у молекулярній формі:
Al(СН3СОО)3
+ HOH![]() (AlOH)(СН3СОО)2
+ СН3СООН;
(AlOH)(СН3СОО)2
+ СН3СООН;
AlOH(СН3СОО)2
+ HOH![]() Al(OH)2СН3СОО
+ СН3СООН;
Al(OH)2СН3СОО
+ СН3СООН;
Al(OH)2СН3СОО
+ HOH![]() Al(OH)3
+
СН3СООН.
Al(OH)3
+
СН3СООН.
У даному випадку реакція середовища залежить від співвідношення констант дисоціації слабких кислоти і основи: вона може бути нейтральною, слабкокислою або слабколужною.
Солі слабкої основи та слабкої кислоти можуть підлягати практично повністю прогідролізувати, якщо як продукт гідролізу утворюється дуже слабка
кислота або дуже слабка основа (або одна з речовин є леткою). Наприклад:
A l2S3
+ 6H2O
2Al(OH)3
+ 3H2S.
l2S3
+ 6H2O
2Al(OH)3
+ 3H2S.
Механізм гідролізу солей полягає в поляризаційній взаємодії іонів солі з їхньою гідратною оболонкою. Причому, чим сильніша ця взаємодія, тим інтенсивніше перебігає гідроліз.
Гідроліз є оборотним процесом, тобто його кількісно можна характеризувати константою гідролізу KГ. Розглянемо оборотну реакцію, представлену рівнянням:
KCN
+ H2O![]() HCN
+ KOH.
HCN
+ KOH.
Запишемо даний процес у іонній формі:
CN
+ H2O![]() HCN
+ OH.
HCN
+ OH.
Тоді вираз константи рівноваги реакції матиме такий вигляд:
![]() .
.
У розбавлених розчинах солей рівноважна молярна концентрація води практично не змінюється ([H2O] const), тому константа гідролізу для випадку солі, утвореної сильною основою і слабкою кислотою, визначається таким чином:
KГ = KР [H2O];
![]()
Оскільки йонний добуток води [H+][OH] = 1014, [OH] = 1014/[H+], то:
![]() ;
;
![]() .
(15.13)
.
(15.13)
Аналогічно вираз константи гідролізу солі, утвореної слабкою основою і сильною кислотою, матиме вигляд
![]() .
(15.14)
.
(15.14)
Отже, константа гідролізу солі залежить від іонного добутку води та константи дисоціації кислоти або основи.
Для солі, утвореної слабкою основою і слабкою кислотою, константа гідролізу визначається як:
![]() .
(15.15)
.
(15.15)
Ступенем гідролізу солі г називають відношення частки гідролізованої сол
і до загальної кількості солі у розчині в момент досягнення стану рівноваги.
Аналогічно закону розбавлення Ф.В. Оствальда константа гідролізу:
Kг г2 С(Х),
де С(Х) − молярна концентрація електроліту у розчині, моль/л.
Найчастіше гідроліз є небажаним явищем, тому для його послаблення слід користуватися концентрованими розчинами солей. Оскільки гідроліз є ендотермічним процесом, для його послаблення треба уникати підвищення температури.
Сповільнити процес гідролізу можна, якщо, відповідно до принципу Ле Шательє, підкислювати розчини солей, які мають рН 7, та додавати луги, якщо рН > 7. У таких випадках можна практично повністю припинити гідроліз солі.
