
- •Частина і
- •Частина і
- •1. Класифікація неорганічних сполук
- •1.1. Оксиди
- •Гідроксиди
- •2. Приклади розв’язання типових задач з теми 1
- •3. Основні поняття та закони хімії. Атомно-молекулярне вчення Програмні питання
- •3.1. Основні поняття та закони хімії
- •3.2. Запитання для самостійної підготовки
- •Приклади розв’язання типових задач з теми 3
- •Будова атома. Періодичний закон і періодична система д. І. Менделєєва
- •5.1. Будова атома
- •Основні характеристики елементарних частинок
- •5.2. Періодичний закон і періодична система д. І. Менделєєва
- •5.3. Запитання для самостійної підготовки
- •Приклади розв’язання типових завдань з теми 5
- •Набір квантових чисел для електронів, які характеризуються станом 4d7
- •Набір квантових чисел для атома з електронною конфігурацією 1s22s22p63s23р2
- •2P; 3s; 3d; 4p; 5s; 4d; 6s; 4f (табл. 6.3).
- •Розрахунок енергій ао за правилами Клечковського
- •7. Хімічний зв’язок. Будова молекул. Кристалічний стан речовини
- •7.1. Ковалентний хімічний зв’язок
- •Будова молекул
- •7.3. Іонний та металічний хімічні зв’язки. Міжмолекулярна взаємодія
- •Кристалічний стан речовини
- •Запитання для самостійної підготовки
- •Приклади розв’язання типових завдань з теми 7
- •Валентність Брому і за електронною конфігурацією
- •Елементи хімічної термодинаміки Програмні питання
- •9.1. Короткі теоретичні відомості
- •9.2. Запитання для самостійної підготовки
- •10. Приклади розв’язання типових задач
- •32 Г сірки (1 моль) виділяється 296,9 кДж;
- •Вплив температури на можливість перебігу хімічних процесів
- •11. Хімічна кінетика і хімічна рівновага Програмні питання
- •11.1. Кінетика хімічних процесів
- •11.2. Рівноважні процеси
- •Константа рівноваги
- •11.3. Запитання для самостійної підготовки
- •12. Приклади розв’язання типових задач з теми 11
- •За формулою (9.4) розраховуємо зміну вільної енергії Гіббса у хімічній реакції
- •13. Розчини. Загальні властивості розчинів неелектролітів Програмні питання
- •Властивості розчинів неелектролітів
- •13.3. Запитання для самостійної підготовки
- •Приклади розв’язання типових задач з теми 13
- •Тиск насиченої пари над розчином розраховуємо за формулою:
- •15. Розчини електролітів
- •15.1. Електролітична дисоціація у розчинах електролітів
- •15.2. Особливості розчинів електролітів
- •15.3. Напрям перебігу процесів у розчинах електролітів. Іонно-молекулярні рівняння
- •Тобто реакція зліва направо не перебігає. Слід пам’ятати, що серед основ сильними електролітами є тільки основи лужних та лужно-земельних металів:
- •15.4. Електролітична дисоціація води. Водневий показник рН
- •15.5. Добуток розчинності
- •15.6. Гідроліз солей
- •У молекулярному вигляді:
- •15.7. Запитання для самостійної підготовки
- •16. Приклади розв’язання типових задач
- •Використовуючи формулу (13.7), знаходимо ізотонічний коефіцієнт
- •Стандартні ентальпії утворення , ентропії та енергії Гіббса утворення деяких речовин при 298 к
- •Інтегральні теплоти розчинення деяких речовин у воді
- •Список рекомендованої та додаткової літератури
Тобто реакція зліва направо не перебігає. Слід пам’ятати, що серед основ сильними електролітами є тільки основи лужних та лужно-земельних металів:
LiOH, NaOH, KOH…, Ca(OH)2, Ba(OH)2, …
Сильні кислоти є також сильними електролітами. Їх не так багато: HCl, HBr, HI, HNO3, H2SO4, HClO4, HMnO4, H2CrO4, H2Cr2O7. Розчинні у воді солі також в іонних реакціях записуємо у вигляді іонів (додаток 4).
15.4. Електролітична дисоціація води. Водневий показник рН
Вода є досить слабким електролітом. Спрощена схема дисоціації молекул
води, якою часто користуються, має вигляд:
Н2О![]() Н+
+ ОН.
Н+
+ ОН.
Іон гідрогену Н+ не може окремо існувати у водному розчині, оскільки він сильно гідратований – взаємодіє з молекулами води з утворенням іонів гідроксонію Н3О+. Тому рівняння дисоціації води можна записати таким чином:
2Н2О![]() Н3О+
+ ОН.
Н3О+
+ ОН.
Тоді вираз для константи дисоціації води має вигляд:
![]() .
.
Причому, у чисельнику – добуток рівноважних концентрацій іонів, а у знаменнику – рівноважна концентрація води. Оскільки вода дисоціює досить погано, вважають, що її рівноважна концентрація [H2O] практично не відрізняється від початкової молярної концентрації C(H2O), яку можна визначити таким чином:
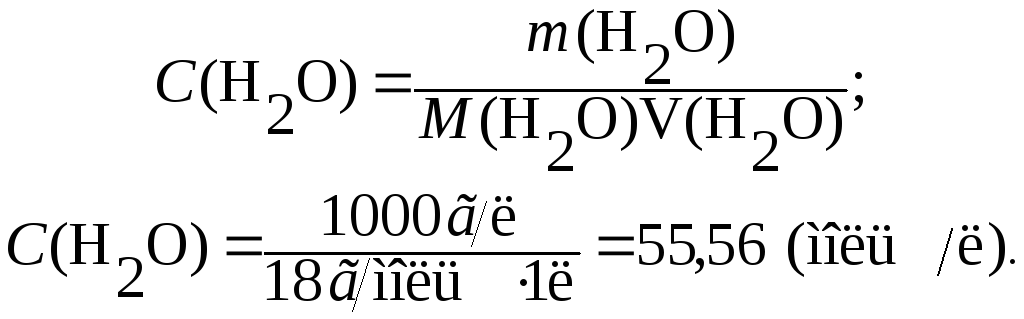
Отже, C(H2O) [H2O] = 55,56 моль/л.
Кондуктометрично
(методом вимірювання електропровідності)
було визначено ступінь
дисоціації води
при 298,15 К (![]() =
1,8
109).
=
1,8
109).
Тоді
константа дисоціації води при 298,15 К
![]()
![]() =
2
С;
=
2
С;
![]() =
(1,8
109)2
55,56 = 1,8
1016
(моль/л),
=
(1,8
109)2
55,56 = 1,8
1016
(моль/л),
а йонний добуток води (константа автоіонізації води) при 298,15 К:
![]() =
[Н+][ОН]
=
=
[Н+][ОН]
=
![]() [Н2О];
[Н2О];
![]() =
1,8
1016
55,56 = 1,0
1014
(моль2/л2)
=
1,8
1016
55,56 = 1,0
1014
(моль2/л2)
Отже,
![]() =
[Н+][ОН]
= 1,0
1014
(
моль2/л2).
(15.4)
=
[Н+][ОН]
= 1,0
1014
(
моль2/л2).
(15.4)
Згідно з формулою (15.4), у чистій воді чи в будь-якому водному розчині при постійній температурі добуток концентрацій іонів гідрогену Н+ та гідроксильних іонів ОН є сталою величиною, яку називають іонним добутком води.
Знаючи
![]() ,
можна визначити рівноважні молярні
концентрації гідроксильних іонів та
іонів гідрогену за формулами:
,
можна визначити рівноважні молярні
концентрації гідроксильних іонів та
іонів гідрогену за формулами:
[ОН]
=
![]() ;
(15.5)
;
(15.5)
[Н+]
=
![]() . (15.6)
. (15.6)
Зазначимо, що процес дисоціації води є ендотермічним, тобто відбувається з
поглинанням
теплоти (
0дис
= 57,3 кДж/моль). Іонний добуток води
(константа автоіонізації води) залежить
від температури: з підвищенням температури
він трохи збільшується. Однак при
температурах, близьких до кімнатної,
можна вважати
![]() =
1,0
1014
моль2/л2.
=
1,0
1014
моль2/л2.
У нейтральному середовищі концентрації іонів Н+ і ОН однакові, тобто [Н+] = [ОН] = 107 моль/л. У кислих розчинах [Н+] [ОН], тоді як у лужних [Н+] [ОН]. Тому кислотність та лужність розчину кількісно можна характеризувати концентрацією одного з цих іонів.
Для характеристики кислотності середовища датський біохімік С. Серен-сен (1909 р.) запропонував використовувати водневий показник рН, який дорівнює десятковому логарифму концентрації іонів гідрогену, взятому з протилежним знаком:
рН = lg[H+] (15.7)
Тоді
[Н+] = 10рН. (15.8)
Аналогічно гідроксильний показник рОН визначають за формулою,
рОН = lg[ОH]; (15.9)
[ОН] = 10рОН (15.10)
Для розбавлених розчинів при температурі близько 20…25 С виконується умова:
рН + рОН = 14. (15.11)
Для точних вимірювань рН розчинів зазвичай використовують рН-метри.
