
- •Розділ 1. Механіка.
- •Тема 1.1 Кінематика. Заняття 1. Вступ. Основні поняття кінематики.
- •Зародження та розвиток фізики як науки.
- •Роль фізики у житті людини та в розвитку суспільства.
- •Методи наукового пізнання.
- •Основні поняття кінематики.
- •Скалярні та векторні величини. Дії над векторами.
- •Заняття 2. Прямолінійний рух.
- •Рівномірний прямолінійний рух.
- •Швидкість руху. Рівняння рівномірного прямолінійного руху.
- •Закон додавання швидкостей.
- •Заняття 3. Рівноприскорений прямолінійний рух.
- •Нерівномірний рух. Середня швидкість. Миттєва швидкість.
- •Прискорення.
- •Рівняння рівноприскореного прямолінійного руху.
- •Заняття 4. Вільне падіння тіл. Рух тіла по колу.
- •Вільне падіння тіл. Прискорення вільного падіння.
- •Рівняння вільного падіння.
- •Рівняння вільного падіння тіла коли:
- •Рівномірний рух тіла по колу. Період і частота обертання.
- •Кутова і лінійна швидкість.
- •Доцентрове прискорення.
- •Тема 1.2 Динаміка. Заняття 5. Закони Ньютона.
- •Перший закон Ньютона. Інерціальна система відліку.
- •Інерція та інертність. Маса.
- •Сила. Другий закон Ньютона.
- •Третій закон Ньютона.
- •Заняття 6. Сила тяжіння.
- •Гравітаційна взаємодія. Закон всесвітнього тяжіння.
- •Вага і невагомість. Штучні супутники Землі.
- •Заняття 7. Деформація тіл. Сили пружності та тертя.
- •Деформація тіл. Механічні властивості твердих тіл.
- •2. Сила пружності. Закон Гука.
- •Сили тертя.
- •Заняття 8. Рух тіла під дією кількох сил. Рівновага тіл.
- •Рух тіла під дією кількох сил.
- •Рівновага тіл, що не обертаються.
- •Рівновага тіл, що мають вісь обертання.
- •Тема 1.3 Закони збереження. Заняття 9. Закон збереження імпульсу.
- •Імпульс тіла.
- •Закон збереження імпульсу.
- •Реактивний рух.
- •Заняття 10. Закон збереження механічної енергії.
- •Механічна енергія.
- •2. Кінетична і потенціальна енергія.
- •3. Закон збереження енергії в механічних процесах.
- •Розділ 2. Молекулярна фізика.
- •Тема 2.1 Властивості газів, рідин, твердих тіл. Заняття 11. Основи молекулярно- кінетичної теорії.
- •Основні положення молекулярно- кінетичної теорії.
- •Розміри і маси молекул та атомів. Кількість речовини.
- •Маси атомів деяких хімічних елементів
- •Тепловий рух молекул.
- •Взаємодія молекул речовини.
- •Заняття 12. Ідеальний газ.
- •Температура та її вимірювання.
- •Властивості газів. Модель ідеального газу.
- •Основне рівняння молекулярно-кінетичної теорії.
- •Рівняння стану ідеального газу.
- •Заняття 13. Газові закони.
- •Рівняння Менделєєва-Клапейрона.
- •Ізопроцеси в газі.
- •Заняття 14. Властивості пари.
- •Пароутворення і конденсація.
- •Насичена і ненасичена пара.
- •Кипіння рідини.
- •Вологість повітря. Точка роси.
- •Вимірювання вологості повітря.
- •Заняття 15. Властивості рідин.
- •Поверхневий натяг.
- •Змочування. Капілярні явища.
- •Заняття 16. Властивості твердих тіл.
- •Кристалічні та аморфні тіла.
- •Аморфні тіла.
- •Рідкі кристали.
- •Полімери.
- •Лабораторна робота №4. Вимірювання відносної вологості повітря.
- •Тема 2.2 Основи термодинаміки. Заняття 17. Внутрішня енергія тіл. Перший закон термодинаміки.
- •Внутрішня енергія тіл.
- •Два способи зміни внутрішньої енергії тіла.
- •Перший закон (початок) термодинаміки.
- •Заняття 18. Робота газу у термодинамічному процесі..
- •Робота газу.
- •Адіабатний процес.
- •Заняття 19. Теплові машини.
- •Теплові машини. Холодильна машина.
- •Необоротність теплових процесів.
- •Додатки
- •Плавлення твердих тіл
- •Перелік літератури
- •Л.С. Жданов, г.Л. Жданова. Физика для средних специальных заведений – м.: Наука, 1984.
- •Сборник задач и вопросов по физике для средних специальных заведений / Под ред. Р.А. Гладковой – м.: Наука, 1988.
-
Ізопроцеси в газі.
Стан газу визначається трьома термодинамічними параметрами: тиском р, температурою Т і об’ємом V.
Коли у газах відбуваються будь-які процеси, то при цьому можуть змінюватися усі ці три параметри газу.
П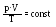 ри
цьому для одного стану незмінної маси
газу об’єднаний газовий закон (ОГЗ)
має вигляд:
ри
цьому для одного стану незмінної маси
газу об’єднаний газовий закон (ОГЗ)
має вигляд:
Для даної маси газу добуток тиску на об’єм, поділений на абсолютну температуру, є величиною сталою.
Для двох станів незмінної маси ідеального газу ОГЗ має вигляд:
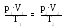
Найпростішими є процеси, у яких змінюються лише два параметри, а третій залишається незмінним.
Процеси, що відбуваються при незмінному значенні одного із параметрів називають ізопроцесами. Розрізняють три види ізопроцесів: ізохорний (V = const), ізобаричний (р = const) та ізотермічний (Т = const).
Кількісні залежності між двома параметрами газу при фіксованому значенні третього параметра називають газовими законами.
Процес зміни стану термодинамічної системи при сталій температурі називають ізотермічним.
В ізотермічному процесі не змінюються температура і маса газу (Т = const, m = const), а змінюються тиск газу р і об’єм газу V.
Ізотермічний процес підпорядковується закону Бойля - Маріотта: за незмінної маси газу та незмінної температури добуток тиску газу р на його об’єм V є величина стала.
рV = const .
Для двох станів газу маємо:
р1V1 = р2V2.
Процес зміни стану термодинамічної системи при сталому тиску називають ізобаричним.
Ізобаричний процес підпорядковується закону Гей - Люсака: при постійній масі газу та незмінному тиску об’єм газу V прямо пропорційний його абсолютній температурі Т.
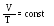
Д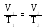 ля
двох станів газу маємо:
ля
двох станів газу маємо:
Процес зміни стану термодинамічної системи при сталому об’ємі називають ізохорним.
Ізохорний процес підпорядковується закону Шарля: при постійній масі газу та незмінному об’ємі тиск газу р прямо пропорційний його абсолютній температурі Т.
З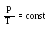 а
умови, що V
= const із
об’єднаного газового закону
отримуємо:
а
умови, що V
= const із
об’єднаного газового закону
отримуємо:
Д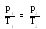 ля
двох станів газу маємо:
ля
двох станів газу маємо:
Задача 53. В балоні місткістю 25,6 л знаходиться 1,04 кг азоту при тиску 3,55 МПа. Визначити температуру газу.
Задача 54. Газ займає об’єм 586 л за температури 293 К і тиску 607,8 кПа. Знайти об’єм газу за температури 248 К і тиску 400 кПа.
Задача 55. Тиск газу за температури 293 К дорівнює 107 кПа. Яким буде тиск газу, якщо його нагріти до 423 К при сталому об’ємі?
Задача 56. Газ займає об’єм 250 см3 за температури 300 К. Який об’єм займе цей газ, якщо його температура зросте до 324 К? Тиск і маса газу незмінні.
Задача 57. Посудину місткістю 12 л, що містить газ за тиску 0,4 МПа, з’єднують з іншою посудиною місткістю 3 л, з якої повністю відкачано повітря. Знайти кінцеве значення тиску. Процес ізотермічний.
Д.З.: 1. §§ 46
2. §§ 5.2 – 5.4, 5.6.
3. Задачі 2.60, 3.3, 3.17.
Заняття 14. Властивості пари.
-
Пароутворення і конденсація.
Внаслідок теплового руху молекули стикаються між собою і обмінюються енергією. При цьому кінетична енергія одних молекул зростає, а інших – збільшується.
Ті молекули, у яких кінетична енергія виявляється більшою за середню кінетичну енергію інших молекул, можуть подолати їх притягання і вилетіти за межі рідини з повітрям, за умови, що вони знаходяться у поверхневому шарі рідини і рухаються у напрямку до неї. Таким чином відбувається процес переходу речовини з рідкого стану в газоподібний. Над поверхнею рідини утворюється пара.
Пароутворення – це. Пароутворення може відбуватися шляхом випаровування або кипіння.
Оскільки з рідини вилітають молекули з досить великою кінетичною енергією, а залишаються – з меншою, то рідина при випаровуванні охолоджується.
Випаровування - це пароутворення, що відбувається лише з вільної поверхні рідини.
Швидкість випаровування (кількість молекул, що випаровуються за одиницю часу) залежить від роду рідини, її температури і від площі вільної поверхні рідини. Крім того, швидкість випаровування рідини залежить від густини пари над її вільною поверхнею. Якщо пару віддаляють від поверхні рідини, то випаровування відбувається інтенсивніше.
Випаровування може відбуватися також з поверхні твердих тіл. Це явище називається сублімацією.
Частина молекул пари внаслідок хаотичності свого руху повертається назад всередину рідини.
Процес переходу речовини з газоподібного стану в рідкий називається конденсацією.
Швидкість конденсації (кількість молекул, що повертаються всередину рідини за одиницю часу) залежить від густини пари.
