
- •Раздел I. Введение
- •1.1 Значение химии для развития машиностроения
- •1.2 Основные понятия химии
- •1.3. Основные законы химии
- •1.3.5. Закон эквивалентов.
- •Правило Дюлонга и Пти
- •Раздел II. Строение вещества
- •2.1.2. Теоретические предпосылки.
- •2.1.3. Современные положения теории строения атома.
- •2.2. Периодический закон и периодическая система элементов д.И.Менделеева
- •2.2.3. Атомные и ионные радиусы
- •Характеристики химической связи.
- •Типы химической связи
- •Метод валентной связи (вс).
- •Предпосылки метода вс
- •Направленность ковалентной связи
- •Донорно-акцепторный механизм образования химической связи
- •Теория гибридизации валентных атомных орбиталей центрального атома
- •Основные положения, положенные в основу теории гибридизации.
- •Модель отталкивания электронных пар валентной оболочки атома (оэпво)
- •Метод молекулярных орбиталей (мо)
- •Основные положения метода мо
- •2. Электроны в молекуле находятся на молекулярных орбиталях.
- •4. Число молекулярных орбиталей равно числу атомных орбиталей.
- •Электронная структура некоторых молекул по методу мо
- •Ионная связь
- •Свойства ионной связи
- •Поляризация ионов
- •1. Равновесие в растворах слабых электролитов
- •2. Если соль образована катионом сильного основания и анионом слабой кислоты, то происходит гидролиз по аниону.
- •3. Если соль образована катионом слабого основания и анионом сильной кислоты, то гидролиз идет по катиону.
- •4. Соль, образованная катионом слабого основания и анионом слабой кислоты, подвергается гидролизу и по катиону и по аниону.
Электронная структура некоторых молекул по методу мо
АО МО АО
Н Е Н![]() Е Н+
Е Н+
В ионе
ионе
![]() кратность связи равна ½.
кратность связи равна ½.
АО МО АО
Ве Е Ве2 Е Ве
В ионе Ве2 кратность связи равна
ионе Ве2 кратность связи равна
![]() .
.
Атомные орбитали первого энергетического уровня образуют молекулярные орбитали, но они полностью заполнены и не влияют на устойчивость молекулы (число электронов на связывающих орбиталях равно числу электронов на разрыхляющих). Таким образом, кратность связи в молекуле Ве2 равна нулю, молекула не существует.
АО МО АО
О Е О2 Е О
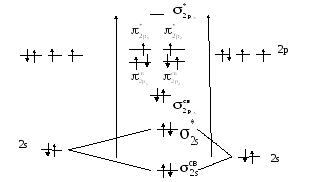
2p
При перекрывании
атомных орбиталей двух атомов кислорода
образуются молекулярные орбитали. Две
2s АО образуют две 2s-МО:
одна
![]() и одна
и одна
![]() .
Шесть 2р атомных орбиталей (три у одного
атома и три у другого) образуют шесть
МО. Причем образуются две МО -типа,
т.е. в направлении между ядрами атомов:
.
Шесть 2р атомных орбиталей (три у одного
атома и три у другого) образуют шесть
МО. Причем образуются две МО -типа,
т.е. в направлении между ядрами атомов:
![]() и
и
![]() и
четыре МО -типа:
и
четыре МО -типа:
![]() .
.
В методе МО
электроны делокализованы. Они принадлежат
всей молекуле, поэтому электроны
распределяются по молекулярным орбиталям
в соответствии с правилами заполнения
атомных орбиталей (принцип наименьшей
энергии, Паули, правило Гунда). Кратность
связи равна
![]() ,
кроме того в молекуле кислорода есть
два неспаренных электрона, что объясняет
его парамагнитные свойства.
,
кроме того в молекуле кислорода есть
два неспаренных электрона, что объясняет
его парамагнитные свойства.
Изучение молекулярных спектров показало, что молекулярные орбитали элементов второго периода располагаются в порядке возрастания энергии следующим образом:
![]() <
<![]() <
<![]() <
<![]() <
<![]() <
<![]() <
<![]() <
<![]() =
=![]() <
<![]()
Значения энергии электронов
на орбиталях
![]() и
и
![]() близки и для некоторых молекул (легких)
Li2, Be2,
B2, C2,
N2 соотношение между
ними обратное приведенному: энергия МО
близки и для некоторых молекул (легких)
Li2, Be2,
B2, C2,
N2 соотношение между
ними обратное приведенному: энергия МО
![]() >
>![]() .
Это связано с отталкиванием
.
Это связано с отталкиванием
![]() и
и
![]() .
Для легких атомов оно более существенно,
т.к. у них энергии 2s и 2р
электронов довольно близки, а разница
в энергии между 2s и 2р
подуровнями по периоду слева направо
увеличивается.
.
Для легких атомов оно более существенно,
т.к. у них энергии 2s и 2р
электронов довольно близки, а разница
в энергии между 2s и 2р
подуровнями по периоду слева направо
увеличивается.
АО МО АО
N Е N2 Е N
Д ля
молекулы азота энергия связи равна 940
кДж/моль, длина связи d=1,1
ля
молекулы азота энергия связи равна 940
кДж/моль, длина связи d=1,1
![]() .
Кратность связи
.
Кратность связи
![]() ,
молекула диамагнитна.
,
молекула диамагнитна.
АО МО АО
 В Е В2 Е
В
В Е В2 Е
В
Для молекулы
В2 кратность связи равна 1, молекула
парамагнитна, энергия связи 288 кДж/моль,
длина связи 1,6
![]() .
.
Ионная связь
Ионная связь осуществляется в результате образования и электростатического взаимодействия противоположно заряженных ионов. Она является предельным случаем полярной ковалентной связи, т.к. при соединении атомов с малой электроотрицательностью (щелочные и щелочно-земельные металлы) и высокой (фтор, кислород, азот) полярность молекулы возрастает настолько, что электронная плотность сильно смещена к атому неметалла и возникают катионы металла и анионы неметалла. Чисто ионная связь не существует, т.к. электронная плотность в молекуле делокализована. Кроме того, полярность молекулы уменьшается в результате поляризации. Даже соединение с максимальной разницей в электроотрицательности атомов ‑ CsF обладает 90% степенью ионности.
Свойства ионной связи
Ионная связь ненаправлена и ненасыщенна. Так как электрическое поле иона имеет сферическую симметрию, то в отличие от ковалентной связи ионная связь не обладает направленностью. Взаимодействие двух противоположно заряженных ионов не приводит к полной взаимной компенсации их полей, они сохраняют способность притягивать и другие ионы, поэтому ионная связь не обладает насыщаемостью. Каждый ион в молекуле с ионной связью окружен ионами противоположного знака, число которых определяется размерами и силой отталкивания одноименнозаряженных ионов. Соединения с ионной связью представляют собой кристаллические вещества. Ионный кристалл можно рассматривать как гигантскую молекулу, состоящую из очень большого числа ионов, в них нет отдельных молекул. Эти вещества при растворении в полярных растворителях распадаются на ионы, а в неполярных не растворяются. Ионные молекулы можно обнаружить только в парах ионных соединений (требуется высокая температура), при этом в парах присутствуют и различные ассоциаты. Например, в парах хлорида натрия присутствуют: NaCl, (NaCl)2, (NaCl)3 и ионы (Na2Cl)+, (NaCl2)- и т.д. Энергию кристаллической решетки обычно определяют экспериментально.
Степень ионности
рассчитывается по формулам:
![]() ,
,
где: ω – степень окисления; эксп. – экспериментальный дипольный момент;
l – расстояние между ионами; qэфф. и qфор. – практические и теоретические заряды на ионах.
