
- •Профессия: Аппаратчик хво
- •Расчет по уравнениям
- •Растворы
- •2. Концентрация растворов
- •4.Пересыщенные растворы
- •Растворы электролитов. Теория электролитической диссоциации.
- •2.Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации.
- •3.Реакции нейтрализации
- •Произведение растворимости
- •5.Диссоциация воды. Водородный показатель.
- •6.Индикаторы
- •Гидролиз солей
- •Характеристика природных вод
- •Основные показатели качества воды
- •Титр. Титрование.
- •Титр. Титрованный раствор.
2.Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации.
А)КИСЛОТЫ
Свойства:
-
способность взаимодействовать с основаниями с образованием солей
-
способность взаимодействовать с некоторыми металлами с выделением водорода
-
способность изменять цвет индикатора (красная окраска лакмуса)
-
кислый вкус
Согласно теории электролитической диссоциации кислоты – это электролиты, диссоциирующие в растворах с образованием ионов (катионов) водорода и анионов кислотного остатка.
Именно ионы водорода вызывают красный цвет лакмуса и сообщают кислотам кислый вкус.
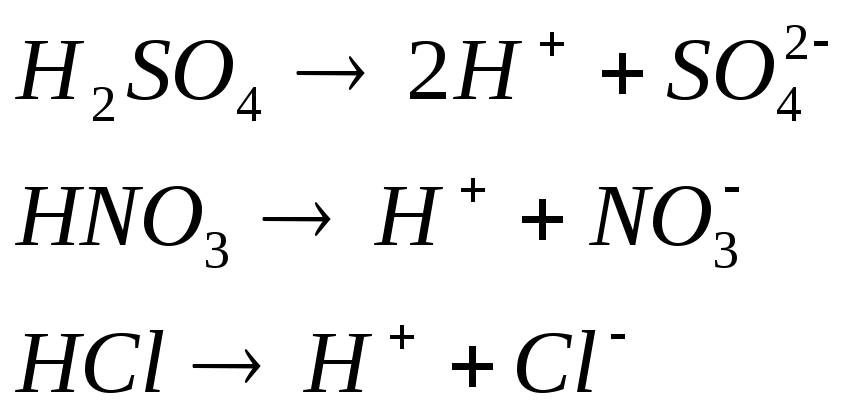
Б)ОСНОВАНИЯ
Свойства:
-
способность взаимодействовать с кислотами с образованием солей
-
способность изменять цвет индикатора иначе, чем их изменяют кислоты (синяя окраска лакмуса)
-
своеобразный «мыльный вкус»
Согласно теории электролитической диссоциации основания – это электролиты, диссоциирующие в растворах с образованием аниона гидроксила и катиона металла.
Носителем щелочных свойств является анион гидроксила.
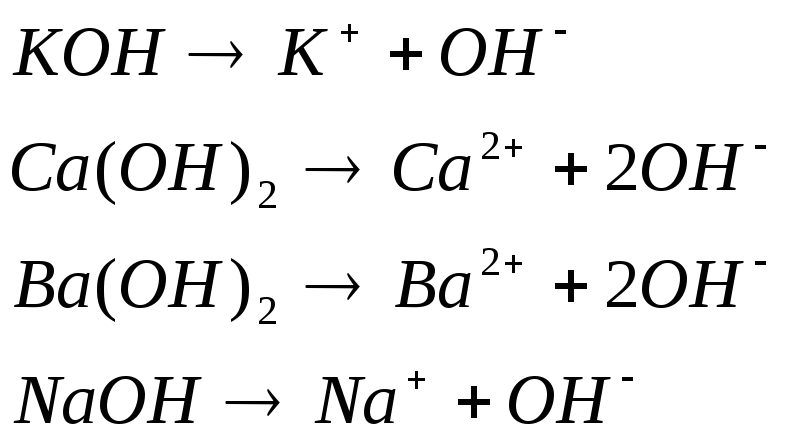
В)СОЛИ
![]()
![]()
Соли при электролитической диссоциации распадаются на катион металла и анион кислотного остатка. Так как таких ионов, которые были бы общими для водных растворов всех солей нет, поэтому соли и не обладают общими свойствами.
3.Реакции нейтрализации
А) при нейтрализации любой сильной кислоты любым сильным основанием на каждую грамм-молекулу образующейся воды выделяется около 13,8 ккал теплоты.
![]()
Это говорит о том, что подобные реакции сводятся к одному процессу. Рассмотрим одну из этих реакций. Перепишем уравнение первой реакции, записывая сильные электролиты в ионной форме, а слабые - в молекулярной, поскольку они находятся в растворе преимущественно в виде молекул.
![]() (вода очень слабый электролит)
(вода очень слабый электролит)
В ходе реакции
ионы Na+
и
![]() не
претерпели изменений. Поэтому исключим
эти ионы из обеих частей уравнения.
Получим:
не
претерпели изменений. Поэтому исключим
эти ионы из обеих частей уравнения.
Получим:
![]()
Таким образом, реакции нейтрализации любой сильной кислоты любым сильным основанием сводятся к одному и тому же процессу – к образованию молекул воды из ионов водорода и гидроксила.
Реакция образования воды из ионов обратима
![]()
Но так как вода слабый электролит и диссоциирует в ничтожно малой степени, то равновесие в этой реакции сильно смещено в сторону образования молекул. Поэтому практически реакция нейтрализации сильной кислоты сильным основанием протекает до конца.
В дальнейшем мы будем широко пользоваться ионно-молекулярной формой записи уравнений реакций с участием электролитов.
При составлении ионно-молекулярных уравнений надо знать, какие соли растворимы в воде и какие практически нерастворимы.
Общие данные о растворимости важнейших солей обычно приведены в таблицах во всех учебниках химии.
Б) нейтрализация слабой кислоты сильным основанием
![]()
Здесь сильные электролиты – NaOH и соль, а слабые – кислота и вода:
![]()
Так как только ионы натрия не претерпевают изменений, то ионно-молекулярное уравнение имеет вид:
![]()
В) нейтрализация сильной кислоты слабым основанием
![]()
Здесь в виде ионов мы должны записать кислоту и образующуюся соль, а в виде молекул – гидроксид аммония и воду:
![]()
Не изменяются
только ионы
![]() .
Опуская их, получаем ионно-молекулярное
уравнение:
.
Опуская их, получаем ионно-молекулярное
уравнение:
![]()
Г) нейтрализация слабой кислоты слабым основанием
![]()
В этой реакции все вещества, кроме образующейся соли, слабые электролиты. Поэтому ионно-молекулярная форма имеет вид:
![]()
ВЫВОД:
Реакции нейтрализации сильных кислот сильными основаниями протекают практически до конца. Реакции нейтрализации, в которых хотя бы одно из исходных веществ – слабый электролит, и при которых молекулы малодиссоциирующих веществ имеются не только в правой, но и в левой части ионно-молекулярного уравнения, протекают не до конца. Они доходят до состояния равновесия, при котором соль существует с кислотой и основанием, из которых она образована. Поэтому уравнения подобных реакций правильнее записывать как обратимые реакции.
![]()
