
- •Ответы на вопросы по разделу « Патофизиология типовых патологических процессов» Ответ №1
- •Механизмы возникновения признаков воспаления
- •Этиология воспаления
- •Нейрогуморальные механизмы развития воспаления
- •Стадии воспаления
- •Ответ №2
- •Медиаторы воспаления подразделяются на:
- •Основные группы медиаторов
- •Изменение обмена веществ в тканях при воспалении
- •Пролиферация, механизмы ее развития
- •Ответ №3
- •Изменение реологических свойств крови в очаге воспаления, белкового состава и физико-химических свойств плазмы
- •Экссудация и эмиграция лейкоцитов, механизмы развития, виды экссудатов
- •Ответ №4 Роль реактивности в развитии воспаления
- •Классификация воспаления
- •Особенности воспалительных процессов в челюстно-лицевой области
- •Ответ №5
- •Типы лихорадочных реакций.
- •Особенности лихорадки в раннем детском возрасте
- •Ответ №6 Этиология
- •Гипертермия и ее отличие от лихорадки.
- •Ответ №7
- •Ответ №8
- •Биологическое значение лихорадки
- •Патофизиологические принципы жаропонижающей терапии
- •Ответ №9
- •Ответ №10
Ответ №3
Расстройства кровообращения и микроциркуляции в тканях при воспалении.
Развиваются в 4 стадии:
-
Кратковременное сужение артериол – вызывается раздражением сосудодвигательных нервов повреждающими агентами. Сужение артериол является кратковременным, так как действие первичного раздражителя быстро проходит. Медиатор симпатической иннервации норадреналин быстро разрушается моноаминооксидазами, количество которой увеличено в воспаленной ткани.
-
Стадия артериальной гиперемии:
-
Расширение артериол, капилляров и венул (механизм связан, с одной стороны, с аксон-рефлекторным возбуждением вазодилататоров, а с другой – с непосредственным сосудорасширяющим действием медиаторов воспаления: нейропетидов, ацетилхолина, гистамина, брадикинина, простагландинов и др.)
-
Ускорение тока крови в сосудах воспаленной ткани
-
Повышение кровяного давления в капиллярах и венулах.
-
Стадия венозной гиперемии (застой крово- и лимфообращения):
-
Внутрисосудистые факторы: сгущение крови (удаление ее жидкой части в ткани в виде экссудата), набухание форменных элементов (действие кислой среды), пристеночное стояние лейкоцитов: повышенная свертываемость крови, закупорка сгустками фибрина
-
Внесосудистые факторы: экссудат сдавливает стенки вен и лимфатических сосудов. Разрушает соединительно-тканный скелет вокруг капилляров.
-
Стаз – местная остановка кровотока в микроциркуляторном русле. Наступает сильное скучивание эритроцитов, но мембраны их не разрушаются. Затем наступает феномен так называемого «слайджа» или картина стирания границ между отдельными эритроцитами. В просвете капилляра находится сплошная, однородная красная масса. Процесс этот обычно необратим.
Изменение реологических свойств крови в очаге воспаления, белкового состава и физико-химических свойств плазмы
При воспалении происходит нарушение реологических свойств крови и ее циркуляции. Сюда относятся повышение вязкости крови вследствие ее сгущения, обусловленного экссудацией, потерей альбуминов, увеличения содержания глобулинов, изменения коллоидного состояния белков, усиление сопротивления кровотоку в результате краевого стояния лейкоцитов, набухания и агрегации эритроцитов, тромбообразование вследствие активации свертывающей системы крови, нарушение характера кровотока – замедление тока крови в осевой зоне, уменьшение краевой плазматической зоны.
Экссудация и эмиграция лейкоцитов, механизмы развития, виды экссудатов
Экссудация (exudatio — потеть) — выход жидкости крови из мелких сосудов через их стенку в ткань или серозные полости при воспалении.
Экссудат (exsudatio — потеть) — воспалительный выпот: вышедшая при воспалении через стенку мелких кровеносных сосудов (капилляров, венул) жидкость, которая собирается в тканях или серозных полостях (плевральной, перикардиальной, брюшной, суставной и др.).
Эмиграция (emigratio — переселяться, выселяться) — выход лейкоцитов из крови через стенку мелких сосудов в ткань или серозные полости при воспалении.
Механизм экссудации включает несколько основных факторов:
-
повышение проницаемости сосудов в результате воздействия медиаторов воспаления и в ряде случаев самого воспалительного агента.
-
увеличение кровяного (фильтрационного) давления в сосудах очага воспаления вследствие гиперемии
-
возрастание осмотического и онкотического давлений крови в воспаленной ткани в результате альтерации и начавшейся экссудации.
-
Активный транспорт – микровезикулярный транспорт (микропиноцитоз эндотелиальными клетками плазмы крови, в виде микропузырьков по направлению к базальной мембране и выбросе ее в ткань)
Ведущим фактором экссудации выступает повышение проницаемости сосудов. Оно имеет 2 фазы:
-
Немедленную – возникает вслед за действием воспалительного агента, достигает максимума на протяжение нескольких минут и завершается в среднем через 15-30 минут, когда проницаемость может возвращаться к норме. В реакцию вовлекаются преимущественно венулы. В результате взаимодействия медиаторов со специфическими рецепторами на мембранах эндотелиальных клеток происходит сокращение актиновых и миозиновых микрофиламентов цитоплазмы клеток и эндотелиоциты округляются, 2 соседние клетки отодвигаются друг от друга, и между ними появляется межэндотелиальная щель, через которую осуществляется экссудация.
-
Замедленную – развивается постепенно, достигает максимума через 4-6 часов и длится иногда до 100 часов в зависимости от вида и интенсивности воспаления. Происходит повреждение стенки лейкоцитарными факторами – лизосомальными ферментами и активными метаболитами кислорода. При этом в процесс вовлекаются не только венулы, но и капилляры.
По отношению к сосудистой проницаемоти медиаторы воспаления могут быть разделены на 2 группы:
-
Прямодействующие, влияющие непосредственно на эндотелиальные клетки, вызывая их контракцию: гистамин, серотонин, брадикинин, лейкотриены
-
Нейтрофилзависимые, эффект которых опосредуется лейкоцитарными факторами: компонент комплемента, лейкотриен В4, цитокины, в частности интерлейкин-1, отчасти фактор активирующий тромбоциты.
Транспорт жидкости в ткани зависит от физико-химических изменений, происходящих по обе стороны сосудистой стенки. В связи с выходом белка его количество вне сосудов увеличивается, что способствует повышению онкотического давления. При этом происходит расщепление белковых и других крупных молекул на более мелкие. Гиперонкия и гиперосмия создают приток жидкости в воспаленную ткань. Этому способствует и повышение внутрисосудистого гидростатического давления в связи с изменениями кровообращения в очаге воспаления.
Экссудат отличается от транссудата тем, что содержит большее количество белков (более 2%). Если проницаемость стенки сосудов нарушена незначительно, то в экссудат, как правило, проникают альбумины и глобулины. При сильном нарушении проницаемости из плазмы в ткань поступает белок с большой молекулярной массой (фибриноген). При первичной, а затем и вторичной альтерации проницаемость сосудистой стенки увеличивается настолько, что через нее начинают проникать не только белки, но и клетки. При венозной гиперемии этому способствует расположение лейкоцитов вдоль внутренней оболочки мелких сосудов и более или менее прочное их прикрепление к эндотелию (феномен краевого стояния лейкоцитов).
Прикрепление лейкоцитов к сосудистой стенке объясняется тем, что ее внутренняя оболочка при воспалении покрывается хлопьевидным слоем, в состав которого входит фибрин, гликозаминогликаны, гликопротеиды, сиаловые кислоты и др.
Различают следующие виды экссудата:
Серозный экссудат характеризуется умеренным содержанием белка (3-5%), в основном мелкодисперсного (альбумин), и небольшим количеством полиморфноядерных лейкоцитов, вследствие чего имеет невысокую удельную плотность (1015-1020) и является достаточно прозрачным. По составу наиболее близок к транссудату. Характерен для воспаления серозных оболочек (серозный перитонит, плеврит, перикардит, артрит и др.), реже встречается при воспалении в паренхиматозных органах. Экссудат при серозном воспалении слизистых оболочек характеризуется большой примесью слизи. Такое воспаление называется катаральным (от греч. katarrheo - стекаться, течь вниз; катаральный ринит, гастрит, энтероколит и др.). Чаще всего серозный экссудат наблюдается при ожоговом, вирусном, аллергическом воспалении.
Фибринозный экссудат отличается высоким содержанием фибриногена, что является результатом значительного повышения проницаемости сосудов. При контакте с поврежденными тканями фибриноген превращается в фибрин и выпадает в виде ворсинчатых масс (на серозных оболочках) или пленки (на слизистых), вследствие чего экссудат уплотняется. Если фибринозная пленка расположена рыхло, поверхностно, легко отделяется без нарушения целостности слизистой, такое воспаление называется крупозным. Оно наблюдается в желудке, кишечнике, трахее, бронхах. В том случае, когда пленка плотно спаяна с подлежащей тканью и ее удаление обнажает язвенную поверхность, речь идет о дифтеритическом воспалении. Оно характерно для миндалин, полости рта, пищевода. Такое различие обусловлено характером эпителия слизистой оболочки и глубиной повреждения. Фибринозные пленки могут самопроизвольно отторгаться благодаря аутолизу, развертывающемуся вокруг очага, и демаркационному воспалению и выходить наружу; подвергаться ферментативному расплавлению или организации, т. е. прорастанию соединительной тканью с образованием соединительнотканных сращений, или спаек. Фибринозный экссудат может наблюдаться при дифтерии, дизентерии, туберкулезе.
Геморрагический экссудат характеризуется большим содержанием эритроцитов, что придает ему розовый или красный цвет. Характерен для туберкулезных поражений (туберкулезный плеврит), чумы, сибирской язвы, черной оспы, токсического гриппа, аллергического воспаления, т. е. для воздействия высоковирулентных агентов, бурно протекающего воспаления, сопровождающегося значительным повышением проницаемости и даже разрушением сосудов. Геморрагический характер может принять любой вид воспаления - серозный, фибринозный, гнойный
Гнойный экссудат характеризуется наличием большого количества полиморфноядерных лейкоцитов, главным образом погибших и разрушенных (гнойные тельца), ферментов, продуктов аутолиза тканей, альбуминов, глобулинов, иногда нитей фибрина, особенно нуклеиновых кислот, обусловливающих высокую вязкость гноя. Вследствие этого гнойный экссудат является достаточно мутным, с зеленоватым оттенком. Он характерен для воспалительных процессов, вызванных кокковой инфекцией, патогенными грибками или химическими флогогенами, такими как скипидар, отравляющие вещества.
Гнилостный (ихорозный) экссудат отличается наличием продуктов гнилостного разложения тканей, вследствие чего имеет грязно-зеленую окраску и дурной запах. Образуется в случае присоединения патогенных анаэробов.
Смешанные экссудаты наблюдаются при воспалении, протекающем на фоне ослабленных защитных сил организма и присоединения вследствие этого вторичной инфекции. Различают се-розно-фибринозный, серозно-гнойный, серозно-геморрагический, гнойно-фибринозный экссудаты.
Защитная роль экссудации:
-
Экссудация обеспечивает поставку в ткань плазменных медиаторов - активных компонент: комплемента, кининов, факторов свертывания системы, ферментов плазмы, биологически активных веществ, высвобождаемых активированными клетками крови.
-
Совместно с тканевыми медиаторами они участвуют в умерщвлении и лизисе микроорганизмов, привлечения лейкоцитов крови, опсонизации патогенетического агента, стимуляции фагоцитоза, раневом очищении, репаративных явлениях.
-
С экссудатом тока крови в очаг выходят продукты обмена, токсины, т. е. очаг воспаления выполняет дренажную элиминативную функцию.
-
Вследствие свертывания лимфы в очаге выпадения фибрина, усугубления венозного застоя и тромбирования венозных и лимфатических сосудов экссудат участвует в задержке в очаге микробов, токсинов, продуктов обмена.
Осложнения воспалительного процесса:
-
Поступлению экссудата в полости тела с развитием, например, плеврита, перикардита, перитонита;
-
Сдавление близлежащих органов;
-
Гноеобразование с развитием абсцесса, эмпиемы, флегмоны, пиемии.
-
Образование спаек может вызвать смещение и нарушение функций органов.
-
Образование на слизистой оболочке гортани при дифтерии фибринозного экссудата, может привести к асфиксии.
Эмиграция лейкоцитов
Выход лейкоцитов из сосудов в ткань - эмиграция. Осуществляется путем диапедеза главным образом через стенку венул. Эмиграция лейкоцитов в очаг является ключевым событием патогенеза воспаления. Лейкоциты служат основными эффекторами воспаления. Внеклеточные бактерицидный и литический эффекты лейкоцитарных продуктов и фагоцитоз играют решающую роль в борьбе с флогогеном. Одновременно, оказывая влияние на клетки, сосуды и кровь, компоненты лейкоцитов выступают как важные медиаторы и модуляторы воспаления, в том числе повреждения собственных тканей. Осуществляя раневое очищение, фагоциты и их продукты создают предпосылки для репаративных явлений, в которых также играют определенную роль, стимулируя пролиферацию, дифференцировку и функциональную активность фибробластов и других клеток. Механизм эмиграции состоит в явлении хемотаксиса (И. И. Мечников).
Пусковым моментом активации фагоцитов является воздействие на рецепторы (часто специфические) клеточных мембран разнообразных хемотаксических агентов, высвобождаемых микроорганизмами или фагоцитами, а также образующихся в ткани в результате действия воспалительного агента или под влиянием самих фагоцитов.
Наиболее важными из хематтрактантов являются фрагменты комплемента, фибринопептиды и продукты деградации фибрина, калликреин, проактиватор плазминогена, фрагменты коллагена, фибронектин, метаболиты арахидоновой кислоты, цитокины, лимфокины, бактериальные пептиды, продукты распада гранулоцитов.
В результате связывания хематтрактантов с рецепторами и активации ферментов плазматической мембраны в фагоците развивается дыхательный (респираторный, метаболический) взрыв, состоящий в резком повышении потребления кислорода и образовании активных его метаболитов. Этот процесс не имеет отношения к обеспечению фагоцита энергией. Он направлен на дополнительное вооружение фагоцита высокореактивными токсическими веществами для более эффективного уничтожения микроорганизмов. Наряду с дыхательным взрывом в фагоците происходят другие изменения. Они включают повышенную выработку особых мембранных гликопротеинов, определяющих адгезивность фагоцита, понижение поверхностного натяжения мембраны и изменение коллоидного состояния участков цитоплазмы (обратимый переход из геля в золь), что создает условия для образования псевдоподий; активацию актиновых и миозиновых микрофиламентов, лежащую в основе миграции; усиленную секрецию с выделением веществ, облегчающих прикрепление лейкоцита к эндотелию, таких как лактоферрин, катионные белки, фибронектин, интерлейкины.
Лейкоциты выходят из осевого тока крови в плазматический. Этому способствует нарушение реологических свойств крови, замедление кровотока, изменение его характера, в частности уменьшение краевой плазматической зоны.
Вследствие возрастания адгезивных свойств не только лейкоцитов, но прежде всего и главным образом эндотелиальных клеток происходит приклеивание лейкоцитов к эндотелию -развивается феномен краевого стояния лейкоцитов.
Повышение адгезивности эндотелия может быть обусловлено усиленной продукцией им адгезивных гликопротеинов (лектинов) и других веществ, которые включаются в состав фибриновой пленки, в норме покрывающей эндотелий со стороны просвета сосуда. Предполагается также, что оно может быть связано с фиксацией на эндотелиальных клетках хематтрактантов, впоследствии взаимодействующих со специфическими рецепторами на лейкоцитах, или же с усилением экспрессии на эндотелиоцитах рецепторов к иммуноглобулину G и фрагменту комплемента СЗb, что приводит к фиксации здесь сначала IgG и СЗb, а уже к ним - лейкоцитов, которые также обладают рецепторами к IgG и СЗb.
Первоначальный контакт лейкоцитов с эндотелием является весьма непрочным, так что под влиянием кровотока они могут перекатываться по поверхности фибриновой пленки, однако контакт быстро упрочивается. Определенное значение здесь придается электростатическим силам. В результате активации отрицательный заряд лейкоцита снижается, что уменьшает силы взаимного отталкивания между ним и эндотелиоцитом, также обладающим отрицательным зарядом. Это, в свою очередь, создает условия для образования между лейкоцитом и эндотелием кальциевых мостиков.
По некоторым данным, Са2+ и другие двухвалентные ионы могут играть ключевую роль в прилипании лейкоцитов.
Занявшие краевое положение лейкоциты выпускают псевдоподии, которые проникают в межэндотелиальные щели, и таким образом «переливаются» через эндотелиальный слой (рис. 64). Повышенные сосудистая проницаемость и ток жидкости из сосуда в ткань играют роль способствующих факторов эмиграции: чем сильнее, тем легче для лейкоцита прохождение сосудистой стенки. Тем не менее эмиграция - процесс полностью активный. Он требует энергии и осуществляется с усиленным потреблением кислорода и участием ионов кальция и магния, необходимых для контрактильных явлений в лейкоците. Оказавшись между эндотелиальным слоем и базальной мембраной, лейкоцит выделяет лизосомальные протеиназы, растворяющие ее, а также катионные белки, изменяющие коллоидное состояние базальной мембраны (обратимый переход из геля в золь), что обеспечивает повышенную проходимость ее для лейкоцита. Иммигрировавшие лейкоциты отделяются от наружной поверхности сосудистой стенки и амебоидными движениями направляются к центру очага воспаления, что определяется градиентом концентрации хемотаксических веществ в очаге. Некоторую роль могут играть электрокинетические явления, обусловленные разностью потенциалов между отрицательно заряженным лейкоцитом и положительным зарядом ткани, характеризующейся Н+-гиперионией.
Первоначально среди лейкоцитов экссудата в очаге острого воспаления преобладают гранулоциты, в основном нейтрофилы, а затем - моноциты-макрофаги. Позже в очаге накапливаются лимфоциты.
Поскольку замедление кровотока в отдельных разветвлениях микроциркуляторного русла и краевое стояние лейкоцитов могут развиваться весьма быстро, а мигрирующему нейтрофилу достаточно 3-12 мин, чтобы пройти эндотелий, появление гранулоцитов в очаге может наблюдаться уже к 10-й мин от начала воспаления. Скорость аккумуляции нейтрофилов в очаге является наивысшей в первые два часа, постепенно снижаясь в последующие. Количество их достигает максимума через 4-6 ч. В этот период лейкоциты очага представлены нейтрофилами более чем на 90%. Гранулоциты фагоцитируют бактерии или иные инородные тела и частицы отмирающих клеточных элементов, параллельно осуществляя внеклеточную поставку ферментов, катионных белков, активных метаболитов кислорода. Одновременно происходит массивное разрушение нейтрофилов, останки которых являются важным стимулом расширения инфильтрации, как нейтрофильной, так и моноцитарной. Как и в норме, большинство гранулоцитов, вышедших в ткань, никогда не возвращается в кровоток.
Моноциты обычно преобладают в очаге острого воспаления спустя 16-24 ч и достигают пика, как правило, на 3-й сут. Однако миграция моноцитов из крови в ткань начинается одновременно с миграцией нейтрофилов. Предполагается, что вначале меньшая, чем у нейтрофилов, скорость аккумуляции моноцитов связана с торможением хемотаксиса моноцитов под влиянием продуктов жизнедеятельности нейтрофилов в течение определенного времени, необходимого для полной выраженности нейтрофильной реакции и предупреждения ее моноцитарного контроля. В очаге воспаления наблюдаются постепенное превращение иммигрировавших моноцитов в макрофаги и созревание последних, в процессе которого объем цитоплазмы и органелл в ней увеличивается; в частности, повышается количество митохондрий и лизосом, что имеет существенное значение для полноценного выполнения макрофагами их функций в очаге. Возрастает активность пиноцитоза, в цитоплазме увеличивается количество фаголизосом, повышается число филоподий. Моноциты-макрофаги также являются источником медиаторов воспаления (ферментов, метаболитов кислорода, цитокинов), фагоцитируют бактерии, но имеют преимущественное значение в фагоцитозе останков погибших клеток, в частности нейтрофилов. Поэтому понятна зависимость аккумуляции моноцитов от предыдущего выхода нейтрофилов. Так, у кроликов с нейтропенией моноциты не появляются в очаге воспаления в течение 16 ч, в то время как в естественных условиях воспаления обнаруживаются уже к 4-му ч, а введение в очаг воспаления лейкопеническим животным нейтрофилов восстанавливает обычную аккумуляцию мононуклеаров. Известен также хемотак-сический эффект на моноциты лизатов нейтрофилов, обусловленный отчасти катионными белками лизосомальных гранул.
С другой стороны, аккумуляция нейтрофилов во многом зависит от моноцитов. Особенно, видимо, это касается той части нейтрофильной инфильтрации, которая связана с усиленным кроветворением, поскольку последнее инициируется моноцитарно-макрофагальными гемопоэтическими факторами, в частности интерлей-кином-1, различными типами так называемых колониестимулирующих факторов - веществ преимущественно белковой природы, ответственных за пролиферацию и дифференцировку в костном мозге кроветворных клеток. В настоящее время выделен ряд хемотаксических пептидов из моноцитов человека для нейтрофилов, которым может принадлежать роль в механизме саморегуляции лейкоцитарной реакции очага воспаления. Однако вопрос о механизмах смены клеточных фаз в очаге воспаления, перехода от развертывания воспалительной реакции к ее разрешению относится к наименее изученным в проблеме воспаления.
Клеточный состав экссудата в большой мере зависит от характера и течения воспалительного процесса, в свою очередь определяемых воспалительным агентом и состоянием реактивности организма. Так, экссудат особенно богат нейтрофилами, если воспаление вызвано гноеродными микробами; при аллергическом воспалении в очаге содержится много эозинофилов. Хронические воспалительные процессы характеризуются незначительным содержанием нейтрофилов, преобладанием моноцитов и лимфоцитов.
Иммигрировавшие лейкоциты совместно с пролиферирующими клетками местного происхождения образуют воспалительный инфильтрат. При этом экссудат с содержащимися в нем клетками пропитывает ткань, распределяясь между элементами воспалительного участка и делая его напряженным и плотным. Инфильтрат наряду с экссудатом обусловливает припухлость и имеет значение в возникновении воспалительной боли.
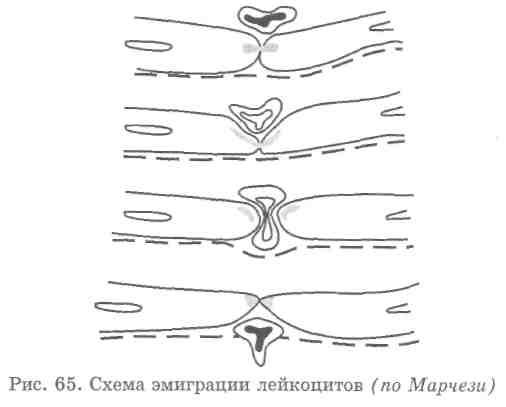
Различают 3 стадии миграции лейкоцитов:
-
Краевое стояние лейкоцитов у внутренней поверхности эндотелия капилляров воспаленной ткани. Краевое стояние длится до несколько часов. В нормальных условиях эндотелий капилляров покрыт тончайшей пленкой из «цемент фибрина». Эта пленка состоит из фибрина, фибрината кальция и продуктов фибринолиза. При воспалении эта пленка может разрушаться и превращаться в клейкую массу, которая приклеивает к себе лейкоциты.
-
Выход лейкоцитов через эндотелиальную стенку – продолжается в течении нескольких минут. Нейтрофилы проходят через межэндотелиальные щели. Лимфоциты сквозь стенки эндотелия.
-
Движение лейкоцитов в воспаленной ткани. Продолжается этот процесс в течении нескольких суток. Движение осуществляется с помощью хемотаксиса при участии цитотаксинов и цитотаксигенов.
