
- •Ответы на вопросы по разделу « Патофизиология типовых патологических процессов» Ответ №1
- •Механизмы возникновения признаков воспаления
- •Этиология воспаления
- •Нейрогуморальные механизмы развития воспаления
- •Стадии воспаления
- •Ответ №2
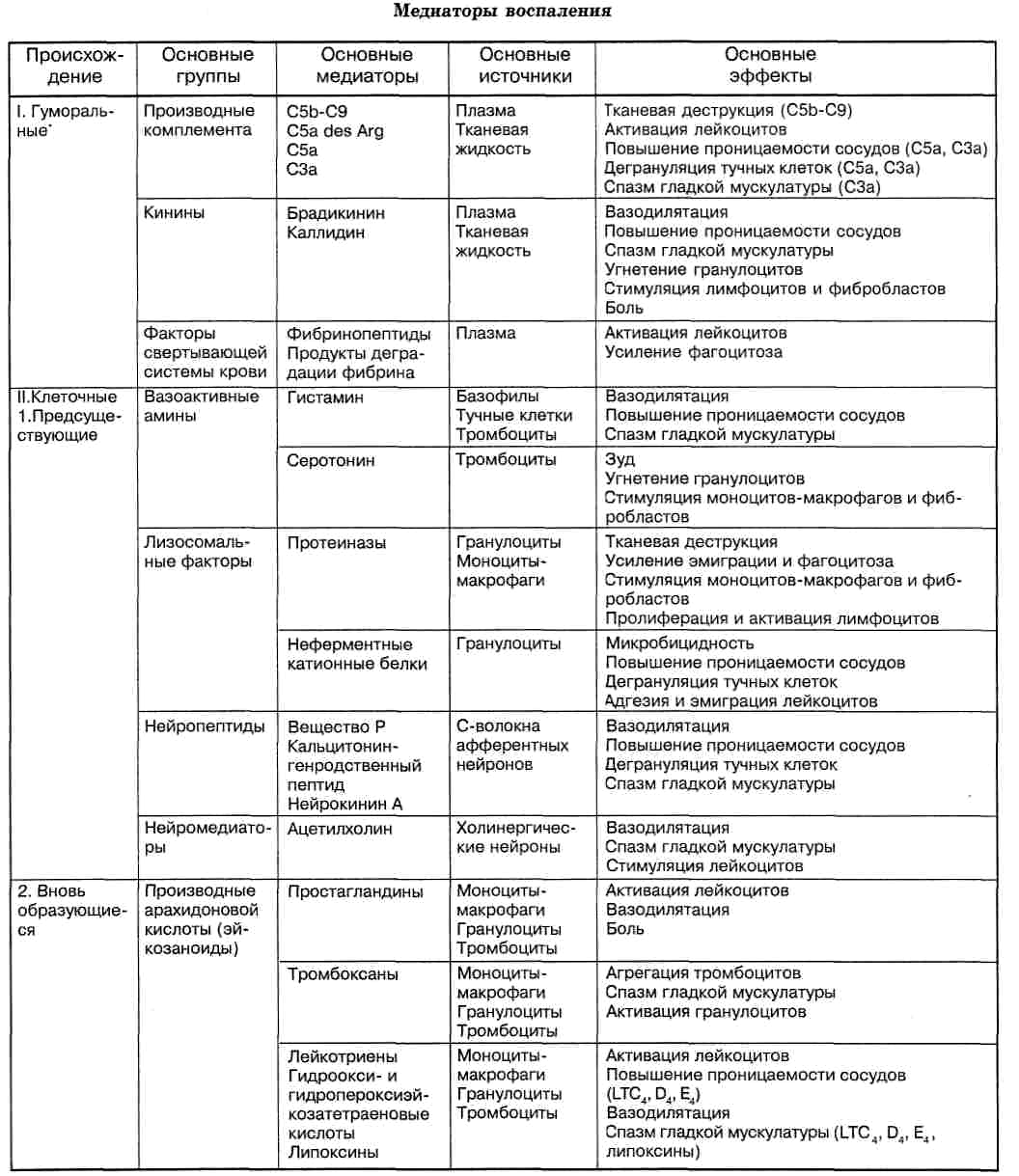
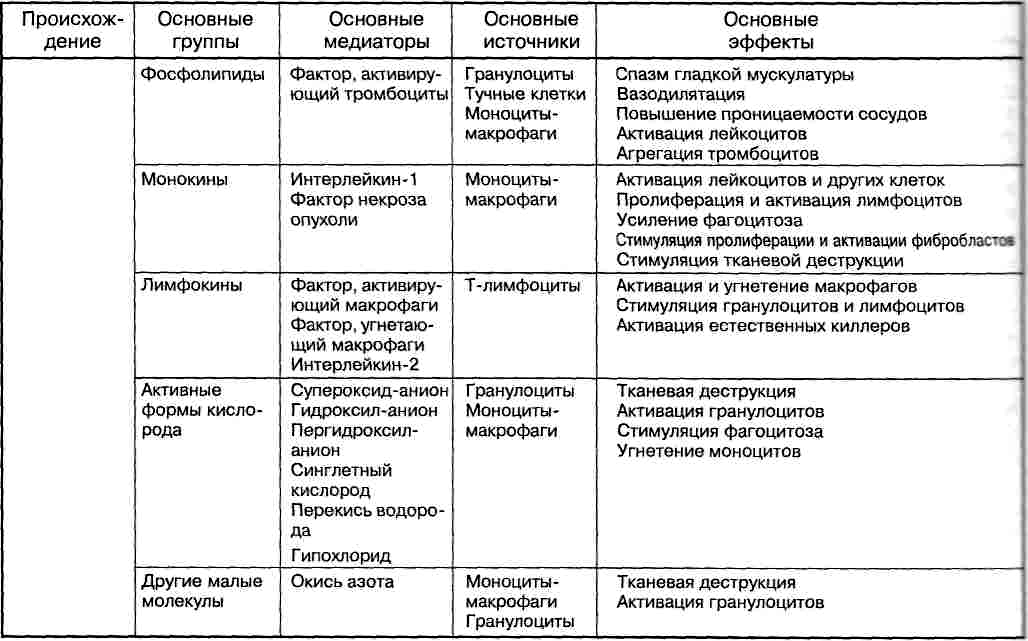
- •Медиаторы воспаления подразделяются на:
- •Основные группы медиаторов
- •Изменение обмена веществ в тканях при воспалении
- •Пролиферация, механизмы ее развития
- •Ответ №3
- •Изменение реологических свойств крови в очаге воспаления, белкового состава и физико-химических свойств плазмы
- •Экссудация и эмиграция лейкоцитов, механизмы развития, виды экссудатов
- •Ответ №4 Роль реактивности в развитии воспаления
- •Классификация воспаления
- •Особенности воспалительных процессов в челюстно-лицевой области
- •Ответ №5
- •Типы лихорадочных реакций.
- •Особенности лихорадки в раннем детском возрасте
- •Ответ №6 Этиология
- •Гипертермия и ее отличие от лихорадки.
- •Ответ №7
- •Ответ №8
- •Биологическое значение лихорадки
- •Патофизиологические принципы жаропонижающей терапии
- •Ответ №9
- •Ответ №10
Пролиферация, механизмы ее развития
Пролиферация (proliferatо от лат. proles -потомство, ferre - создавать). Под воспалительной пролиферацией понимают размножение местных клеточных элементов в очаге воспаления.
Пролиферация развивается с самого начала воспаления наряду с явлениями альтерации и экссудации, но становится преобладающей в более поздний период процесса, по мере стихания экссудативно-инфильтративных явлений. Первоначально она в большей мере выражена на периферии очага. Важнейшим условием прогрессирования пролиферации является эффективность очищения очага воспаления от микроорганизмов или другого вредного агента, продуктов альтерации тканей, погибших лейкоцитов (раневое очищение). Ведущая роль в этом отводится макрофагам - гематогенного (моноциты) и тканевого (гистиоциты) происхождения.
Раневое очищение происходит главным образом путем внеклеточной деградации поврежденной ткани, а также за счет фагоцитоза. Оно осуществляется под регуляторным влиянием цитокинов с помощью таких ферментов, как протеогликаназа, коллагеназа, желатиназа. Активация этих ферментов может происходить под воздействием активатора плазминогена, высвобождаемого при участии цитокинов из мезенхи-мальных клеток. Простагландины, высвобождаясь вместе с ферментами, могут, со своей стороны, индуцировать протеиназы и вносить свой вклад в процессы деградации. Элиминируя останки лейкоцитов и разрушенных тканей, макрофаги устраняют один из важнейших источников собственной хемотаксической стимуляции и подавляют дальнейшее развитие местной лейкоцитарной реакции. По мере очищения очага воспаления количество макрофагов убывает из-за снижения поступления их из крови. Из очага они уносятся восстанавливающимся током лимфы в регионарные лимфоузлы, где погибают. Лимфоциты частью погибают, частью превращаются в плазматические клетки, продуцирующие антитела, и затем постепенно элиминируются.
Пролиферация происходит главным образом за счет мезенхимальных элементов стромы, а также элементов паренхимы органов. В ней участвуют камбиальные, адвентициальные, эндотелиальные клетки. В результате дифференцировки стволовых клеток соединительной ткани -полибластов - в очаге появляются эпителиоидные клетки, фибробласты и фиброциты. Основными клеточными элементами, ответственными за репаративные процессы в очаге воспаления, являются фибробласты. Они продуцируют основное межклеточное вещество - гликозаминогликаны, а также синтезируют и секретируют волокнистые структуры - коллаген, эластин, ретикулин. В свою очередь, коллаген является главным компонентом рубцовой ткани.
Процесс пролиферации находится под сложным гуморальным контролем. Решающее значение здесь имеют опять-таки макрофаги. Они являются основным источником фактора роста фибробластов - термолабильного белка, стимулирующего пролиферацию фибробластов и синтез коллагена. Макрофаги также усиливают привлечение фибробластов в очаг воспаления. Важную роль в этом играет секретируемый макрофагами фибронектин, а также интерлейкин-1. Макрофаги стимулируют пролиферацию эндотелиальных и гладкомышечных клеток, базальной мембраны и, таким образом, образование микрососудов. Угнетение или стимуляция системы мононуклеарных фагоцитов соответственно ослабляет или усиливает развитие грануляционной ткани в очаге гнойного воспаления.
В свою очередь, макрофаги опосредуют регуляторное влияние на фибробласты и пролиферацию Т-лимфоцитов. Последние же активируются протеиназами, образующимися в очаге воспаления в результате распада ткани. Протеиназы могут оказывать непосредственное влияние как на макрофаги, так и на фибробласты. Макрофаги и лимфоциты могут высвобождать моно- и лимфокины, не только стимулирующие, но и угнетающие фибробласты, выступая в качестве истинных регуляторов их функций.
Фибробласты зависят также от тромбоцитарного фактора роста, являющегося термостабильным белком с высоким содержанием цистеина и м.м. 30000Д. В качестве других факторов роста для фибробластов называют соматотропин, соматомедины, инсулиноподобные пептиды, инсулин, глюкагон.
Важную роль в пролиферативных явлениях играют кейлоны - термолабильные гликопротеины с м.м. 40000Д, являющиеся ингибиторами клеточного деления. Механизм действия состоит в инактивации ферментов, участвующих в редупликации ДНК. Одним из основных источников кейлонов являются сегментоядерные нейтрофилы. По мере снижения количества нейтрофилов в очаге воспаления уменьшается содержание кейлонов, что приводит к ускорению деления клеток. По другим предположениям, при воспалении сегментоядерные нейтрофилы практически не вырабатывают кейлоны и усиленно продуцируют антикейлоны (стимуляторы деления); соответственно, деление клеток ускоряется, пролиферация усиливается.
Другие клетки и медиаторы могут модулировать репаративный процесс, воздействуя на функции фибробластов, макрофагов и лимфоцитов. Существенное значение в регуляции репаративных явлений имеют также реципрокные взаимоотношения в системе коллаген - коллагеназа, стромально-паренхиматозные взаимодействия (Д.Н. Маянский).
Пролиферация сменяется регенерацией. Последняя не входит в комплекс собственно воспалительных явлений, однако непременно следует им и трудно от них отделима. Она состоит в разрастании соединительной ткани, новообразовании кровеносных сосудов, в меньшей степени - в размножении специфических элементов ткани. При незначительном повреждении ткани происходит относительно полная ее регенерация. При образовании дефекта он заполняется вначале грануляционной тканью - молодой, богатой сосудами, которая впоследствии замещается соединительной тканью с образованием рубца.
К стимуляторам и ингибиторам репаративной стадии воспаления относятся: фактор роста, раневые гормоны, трофогены. На этой стадии постепенно прекращаются разрушительные процессы и сменяются созидательными процессами. Прежде всего — это размножение клеток и возмещение возникшего ранее дефекта новообразованными клетками. Одновременно с размножением клеток и даже несколько опережая его, идет процесс активного погашения воспалительного процесса, что проявляется ингибицией ферментов, дезактивацией воспаления, расщеплением и выведением токсических продуктов. Активность клеток воспаления тормозится разными механизмами. Что касается ингибиторов, то в этом отношении важнейшую роль играет α2-макроглобулин (α2-М). Этот белок имеет широкий спектр действия. Он является главным ингибитором кининообразующих ферментов крови и таким образом устраняет их влияние: расширение и повышение проницаемости сосудов. Кроме того, он ингибирует большинство протеиназ из лейкоцитов, в том числе коллагеназу и эластазу и тем самым предохраняет от разрушения элементы соединительной ткани. Наконец, макроглобулин α2-М может связываться с мембранами нейтрофилов и таким образом тормозить их реакцию на СЗа и С5а (хемотаксис). В контроль за воспаление включаются и другие ингибиторы, в том числе альфа-антихимотрипсин (α1-АХ), который тормозит катепсин I и химотрипсин. Антитромбин III и α2-антиплазмин ингибируют сериновые ферменты и являются главными ингибиторами системы коагуляции, фибринолиза и комплемента.
Стимуляторы и ингибиторы репаративной стадии воспаления Пролиферация находится под контролем многих рецепторов:
1) Фибробласты синтезируют проколлаген и, в то же время, секретируют коллагеназу, расщепляющую коллаген. Между этими процессами существует взаимодействие по типу ауторегуляции. Нарушение этой регуляции приводит к развитию склеропатий.
2) Фибропектин (фибробласты) детерминирует миграцию, пролиферацию и адгезию клеток соединительной ткани.
3) Фактор стимуляции фибробластов (микрофаги), увеличивает размножение их и адгезивные свойства.
4) Лимфокины и монокины, ингибируют пролиферацию фибробластов и образование коллагена.
5) Простагландины группы Е могут потенциировать рост через усиление кровоснабжения в пролиферирующей ткани.
6) Кейлоны — тканеспецифические ингибиторы, антикейлоны — стимуляторы пролиферации, взаимодействуют по типу обратной связи
7) Глюкокортикоиды тормозят регенерацию, тормозят секрецию коллагена СТГ, минералокортикоиды стимулируют регенерацию.
8) цАМФ — ингибирует (митоз) пролиферацию, цГМФ — стимулирует пролиферацию.
Продукты повреждения ткани являются стимулирующими регенерацию (протеазы, полипептиды, низкомолекулярные белки), раздражители для размножения клеток («раневые гормоны»), продукты распада лейкоцитов «трефоны» (от греч. trephos — питаю), десмоны, витамины С и А.
Избыток ведет к продуктивному воспалению.
|
Клетки воспаления |
||
|
Название клеток |
Вырабатываемые и секретируемые вещества |
Участие в воспалении |
|
Макрофаги: |
Интерлейкин-1, |
Фагоцитоз |
|
фиксированные |
ферменты |
Кооперация с другими клетками воспаления. Действие на фибробласты, лимфоциты, гепатоциты, нейроны |
|
подвижные |
интерферон |
|
|
печеночные |
фрагменты комплемента |
|
|
легочные |
простагландины |
|
|
селезеночные |
ингибиторы протеаз |
|
|
Тучные клетки |
Гистамин, фактор хемотаксиса эозинофилов, гепарин, фактор активации тромбоцитов, медленно реагирующая субстанция |
Выработка биологически активных веществ |
|
Нейтрофилы |
Фактор активации тромбоцитов, лейкотриены, ферменты, антимикробные факторы |
Хемотаксис, фагоцитоз, цитотоксическое действие |
|
Эозинофилы |
Гистаминаза, арилсульфатаза, большой катионный белок |
Деградация гистамина, лейкотриенов |
|
Тромбоциты (кровяные пластинки) |
Простагландины, тромбоксан, лейкотриены; тромбоцитарный фактор роста, фактор проницаемости, катионные белки, серотонин, гистамин, гидролазы, адреналин |
Агрегация, свертывание крови |
|
Лимфоциты Т и В |
Интерлейкины, лимфокины, иммуноглобулины |
Иммунитет, киллерное действие |
|
Фибробласты |
Коллаген, гликозамингликаны, фибронектин |
Миграция, пролиферация, созревание; восстановление дефекта |
|
Медиаторы воспаления |
||
|
Название |
Оказываемое действие |
Происхождение |
|
Клеточные медиаторы |
||
|
Гистамин |
Местное расширение сосудов, повышение их проницаемости, особенно венул |
Гранулы тучных клеток |
|
Серотонин |
Спазм посткапиллярных венул, повышение проницаемости стенки сосудов |
Тромбоциты, хромаффинные клетки слизистой оболочки пищеварительного канала |
|
Лизосомальные ферменты |
Вторичная альтерация, хемотаксис |
Гранулоциты, тканевые базофилы, макрофаги |
|
Катионные белки |
Повышение проницаемости стенки сосудов |
Нейтрофильные гранулоциты |
|
Продукты расщепления арахидоновой кислоты (кислые арахидониды) |
||
|
Простагландины (ПГЕ1) |
Проницаемость сосудов, отек, хемотаксис |
Арахидоновая кислота |
|
Тромбоксан (ТХА2) |
Агрегация тромбоцитов, вазоконстрикция, свертывание крови |
Тромбоциты |
|
Простациклин (ПГИ2) |
Дезагрегация тромбоцитов, расширение сосудов |
Эндотелиоциты |
|
Лейкотриены |
Хемотаксис, сокращение гладких мышц, отек |
Лейкоциты |
|
Гуморальные медиаторы |
||
|
Кинины (брадикинин, каллидин) |
Расширение капилляров, увеличение проницаемости, боль, зуд |
α2-глобулины крови |
|
Система комплемента (фрагменты СЗа, С5а) |
Хемотаксис, цитолиз |
Плазма крови |
