
- •Вопрос 2
- •Вопрос 3
- •Вопрос 4
- •Вопрос 1
- •Вопрос2
- •Вопрос 3
- •2.По характеру функциональных групп:
- •Вопрос 4
- •Вопрос1
- •Вопрос 2
- •Вопрос 3
- •Вопрос 4
- •R группы заряжены отрицательно
- •Вопрос 1
- •Вопрос 2
- •Вопрос 3
- •Вопрос 4
- •Вопрос 1
- •Вопрос 2
- •Вопрос 3
- •Вопрос 4
- •Вопрос 1
- •Вопрос 2
- •Вопрос 3
- •Вопрос 4
- •Вопрос 1
- •Вопрос 2
- •1. Галогенирование
- •2. Нитрование
- •3. Алкилирование
- •Вопрос 3
- •Качественные реакции гликозидов
- •Вопрос 4
- •Вопрос 1(билет 52, вопрос 1) повторяется.
- •Вопрос 2
- •Вопрос 3
- •Вопрос 4
- •Вопрос 2
- •2) Щелочным гидролизом дигалогенокислот
- •Вопрос 3
- •Вопрос 4
- •Вопрос 1
- •Вопрос 2
- •Вопрос 3
- •Вопрос 4
- •Вопрос1
- •Вопрос 2
- •Вопрос 3
- •Вопрос 4
Билет 51
Гетероциклические ароматические соединения. В ряду этих соединений встречаются оба вида сопряжения. Пи-пи-сопряжение характерно для шестичленных гетероциклов с одним или несколькими гетероатомами. Простейшим их представителем является пиридин, содержащий в цикле один атом азота. Атом азота находится в состоянии sp2-гибридизации (две из трех sp2-гибридных орбиталей образуют сигма-связи). Он поставляет в ароматический секстет один р-электрон. Неподеленная пара электронов на sр2-гибридной орбитали обусловливает свойства пиридина как основания. Атом азота с таким электронным строением принято называть пиридиновым. В результате большей электроотрицательности по сравнению с атомом углерода пиридиновый атом азота понижает электронную плотность на атомах углерода ароматического кольца. Поэтому системы с пиридиновым атомом азота называют пи-недостаточными. Кроме пиридина, примером таких систем служит пиримидин, содержащий два пиридиновых атома азота. р-пи-сопряжение осуществляется в пятичленных гетероциклах с атомами азота, кислорода, серы. Довольно часто в составе биологически значимых соединений встречается гетероцикл с одним атомом азота — пиррол. В пирроле от атома азота в ароматический секстет включается находящаяся на негибридизованной р-орбитали пара электронов, три электрона на sp2-гибридных орбиталях участвуют в образовании трех сигма-связей. Атом азота в таком электронном состоянии получил название пиррольного. Шестиэлектронное облако в пирроле делокализовано на пяти атомах цикла, поэтому пиррол представляет собой пи-избыточную систему. В фуране и тиофене ароматический секстет также включает неподеленную пару электронов негибридизованной р-АО кислорода и серы соответственно, в имидазоле два атома азота вносят разный вклад в образование делокализованного электронного облака: пиррольный атом азота поставляет пару n-электронов, а пиридиновый — один р-электрон. В пиррольном и пиридиновом атомах азота электроны находятся на негибридизованных р-АО. Ароматическим характером обладает также пурин, представляющий собой конденсированную систему из двух гетероциклов — пиримидина и имидазола. Делокализованное электронное облако в пурине включает 10 пи-электронов.
![]()
![]()
![]()
![]()
Химические свойства пиррола
-
1)В связи с тем, что n – электроны атома азота втянуты в общий цикл, пиррол обладает очень слабыми основными свойствами. Наоборот, при взаимодействии с Na или К дает соли, проявляя кислотные свойства
2) при обработке пиррола кислотой атакующий протон кислоты локализует пару электронов сектета на атоме азота.
3![]() )
способность пятичленных гетероциклов
вступать в реакции электрофильного
замещения так велика, что их называют
суперароматическими соединениями.
)
способность пятичленных гетероциклов
вступать в реакции электрофильного
замещения так велика, что их называют
суперароматическими соединениями.
![]()
![]()
Химические свойства пиридина
1Пиридин — более слабое основание
2. Ароматические свойства. Подобно бензолу, пиридин вступает в реакции электрофильного замещения, однако его активность в этих реакциях ниже, чем бензола, из-за большой электроотрицательности атома азота. Пиридин нитруется при 300 °С с низким выходом:
3![]() При гидрировании пиридина образуется
пиперидин, который представляет собой
циклический вторичный амин и является
гораздо более сильным основанием, чем
пиридин
При гидрировании пиридина образуется
пиперидин, который представляет собой
циклический вторичный амин и является
гораздо более сильным основанием, чем
пиридин
4 Гомологи пиридина по свойствам похожи на гомологи бензола. Так, при окислении боковых цепей образуются соответствующие карбоновые кислоты:
![]()
Вопрос 2
Простые эфиры-производные спиртов или фенолов, в которых атом водорода гидроксильной группы замещён на углеводородный радикал.
1не смешиваются с водой 2хорошо растворяют многие органические вещества
Слабые нейтральные nоснования. Растворяются в конц. Минеральных кислотах за счёт образования оксониевых солей, гидролизующихся избытком воды.
Диэтиловый эфир+H2SO4=гидросульфат диэтилоксония [(C2H5)2—O+ --H]HSO4—
Гидросульфат диэтилоксония+H2O=H3O+ +H2SO4- +C2H5OC2H5
Малореакционные вещества, инертные к щелочам, большинству кислот и других реагентов
В обычных условиях не гидролизуются
Расщепление эфирной связи лишь в жёстких условиях
Метилфениловый эфир+HBr->метилбромид+фенол
Сложные эфиры-это вещества, которые образуются в результате взаимодействия органических или кислородсодержащих неорганических кислот со спиртами(р-ции этерификации)
Уксусная кислота+этанол= Н+ уксусноэтиловый эфир(этилацетат) +H2O
![]()
![]()
Общая формула OR1 изомерны карбоновым кислоотам
Гидролиз – важнейшее химическое свойство сложных эфиров:
М етилбутират
H2+
T
етилбутират
H2+
T
2 метилпропановая
Многоатомные спирты, как и одноатомные взаимодействуют с органическими и неорганическими кислотами с образованием сложных эфиров
Н2С—ОН Н2С—О—COCH3
HC----OH +3CH3COOH HC----O---COCH3 +3H2O триацетат глицерина (глицерилтриацетат)
H2C---OH H2C---O---COCH3
Н2С—ОН H2C—NO2
HC----OH +3HONO2 H2SO4 конц. HC---NO2 +3H2O тринитрат глицерина(тринитроглицерин)
H2C---OH H2C—NO2
Сложные эфиры глицерина и высших карбоновых кислот представляют собой жиры
Эфир глицерина и пальмитиновой кислоты(трипальмиат глицурина, трипальмитин)
Эфир глицерина и олеиновой кислоты (триолеат глицерина, триолеин)
Эфир глицерина, олеиновой и стеариновой кислот(олеодистеорат глицерина, олеодистеарин)
Эфир глицерина и пальмитиновой,олеиновой и линолевой кислот(пальмитоолеолинолеин)
Вопрос 3
Р![]() еакция
с нингидрином, реакция на α-аминокислоты
(используется для
еакция
с нингидрином, реакция на α-аминокислоты
(используется для
визуального распознавания α-аминокислот)
![]()
![]()
![]()
восстрановленная форма нингидрида
Реакция с 2.4-динитрофторбензолом (ДНФБ)
– используется для отщепления N-концевой аминокислоты (щелочная среда):
образуется комплекс желтого цвета.
![]()
![]() динитрофторбензольное
производное α аланина
динитрофторбензольное
производное α аланина
Реакция с азотистой кислотой используется для количественного определения NH2 групп по объему выделившегося N2
![]() молочная
кислота
молочная
кислота
Реакция карбоксилирования –NH2 приводит к получению двухосновной аминокислоты.
 карбокси
альфааланин
карбокси
альфааланин
Практическое значение имеет реакция формольного титрования, используемая для количественного определения α-аминокислот.
![]()
Реакции дезаминирования (удаление NH2 группы в виде аммиака)
![]() окислительное
окислительное
![]()
Гидролитическое
![]() молочная кислота
молочная кислота
OH
Внутримолекулярное
![]() акриловая
кислота
акриловая
кислота
Восстановительное![]() пропионовая
кислота
пропионовая
кислота
 +2H
+2H
Реакции за счет радикалов используются для идентификации отдельных аминокислот
Окислительно-восстановительное взаимопревращение цистеина
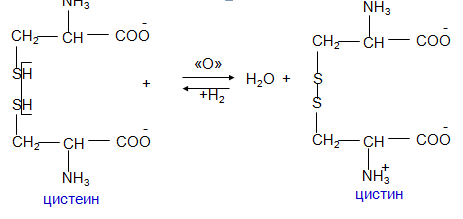
Эта реакция протекает в организме при участии ферментов оксидоредуктаз
Специфические свойства структурных изомеров аминокислот используются для их идентификации
γ, δ – аминокислоты образуют при нагревании циклические амиды - лактамы
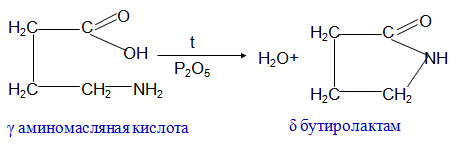
В аминокислоты превращаются в непредельные карбоновые кислоты
![]()
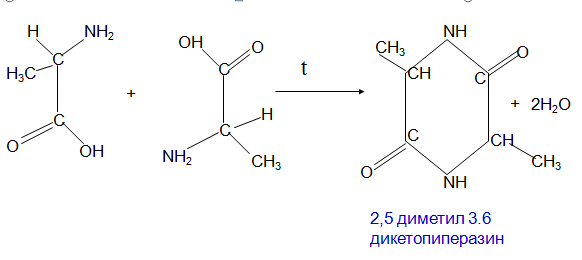
α аминокислоты выделяя 2 моль воды образуют циклические ангидриды, называемые дикетопиперазинами.
