
- •Вопрос 2 амины-производные аммиака .В которых один атом водорода замещен на радикал.На основность аминов влияют природа радикалов и их количество.
- •Вопрос 4 Сахарид галактоза.
- •Вопрос 2. Одноосновные непредельные кислоты - производные ненасыщенных углеводородов, у которых один атом водорода замещен карбоксильной группой.
- •Вопрос 4.Аспаргиновая кислота соон-сн-nh2 этиламин сн3-сн2-nh2
- •Вопрос 2.
- •Вопрос 4.Аланин.(сн3-сн(nh2)cooh)серин (он-сн2-сн(nh2)cooh)пролин связи через азот !!!
- •Вопрос 1. Правила замещения в бензольном кольце: Первый заместитель встает в любое положение и влияет на распределение электронной плотности в кольце.
- •Вопрос 3.
Билет 20
Вопрос 1 Гомолитические реакции. ГОМОЛИТИЧЕСКИЕ РЕАКЦИИ (от греч. homos -равный, одинаковый, общий и lysis-разложение, распад), протекают с гемолизом хим. связи, т.е. с таким ее разрывом, при к-ром электронная пара, осуществляющая связь, разделяется между образующимися фрагментами (своб. радикалами):
![]()
Иногда к гомологическим относят все р-ции, протекающие с участием и образованием своб. радикалов или ион-радикалов .Для осуществления гомолитических реакций обычно используют термохим., каталитич., фотохим., радиационно-хим. и электрохим. методы. Возможность реализации р-ции определяется энергией диссоциации связи. В газовой фазе гомолиз протекает значительно легче, чем гетеролиз. По гомолитич. механизму протекают мн. цепные р-ции, напр. фотогалогенирование предельных углеводородов (металепсия), радикальная полимеризация, нитрование алифатич. соединений. Гомолитические(радикальные)(символ R)в них действуют радикальные реагенты и происходит гомолитический разрыв связи в субстрате(в самом в-ве,а не в реагенте)Cl*+H*/*CH3==HCl+CH3*(одна из стадий цепного свободнорадикального хлорирования метана)
Вопрос 2 амины-производные аммиака .В которых один атом водорода замещен на радикал.На основность аминов влияют природа радикалов и их количество.
а) Алифатические амины R-NH2
Алкильный радикал R (CH3-, C2H5- и т.д.) обладает + I эффектом, повышает электронную плотность на атоме N, увеличивая основные свойства
И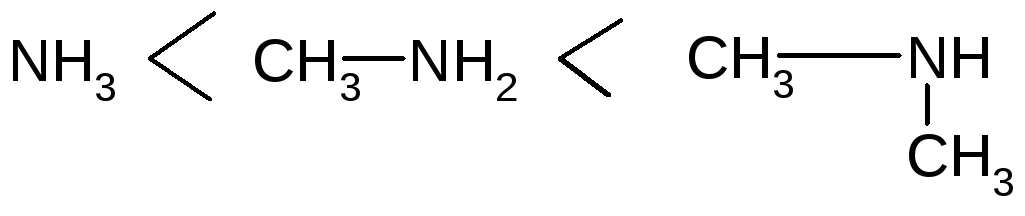 зменение
основных свойств в ряду алифатических
аминов.
зменение
основных свойств в ряду алифатических
аминов.
Усиление основных свойств алифатических аминов в водных растворах.
Третичный амин в водном растворе имеет меньшую основность из-за пространственных факторов и специфической гидратации
Ароматические амины
Арильные радикалы С6Н5- уменьшают основность, т.к. неподеленная электронная пара N участвует в
p-π-сопряжении с бензольным кольцом.
![]()
фениламинанилин дифениламин
R увеличивает основность
Ar уменьшает основность
ЭА заместители и сопряжении уменьшают основность
ЭД увеличивают основность
Вопрс 3 олигосахариды-полисахариды,в состав которых входит от 2 до 10 моносахаридов.дисахариды –олигосахариды состоящие из 2 моносахаридов.при гидролизе дисахаридов образуются два моносахарида,из которых и состоит дисахарид.
Сахароза-невосстанавливающий дисахарид.связь 1-2

 При
алкилировании CH3Cl
происходит замещение водорода в группе
ОН на СН3(будет О-СН3)
При
алкилировании CH3Cl
происходит замещение водорода в группе
ОН на СН3(будет О-СН3)
При ацилировании добавляем (СH3CO)2O ==
+CH3COOH
![]()
Н евосстанавливающие
дисахариды .наибольшее значение в этой
группе имеет сахароза. В ее состав входят
Д-глюкоза в пиранозной форме и Д-фруктоза
в фуранозной форме .гликозидная связь
между ними образуется за счет гидроксильных
групп .в сахарозе отсутствуют свободные
полуацетальные гидроксильные группы
Эпоэтому она не способна к
цикло-оксо-таутомериии р-ры ее не мутируют
.следствием чего является отсутствие
восстановительной способности.
евосстанавливающие
дисахариды .наибольшее значение в этой
группе имеет сахароза. В ее состав входят
Д-глюкоза в пиранозной форме и Д-фруктоза
в фуранозной форме .гликозидная связь
между ними образуется за счет гидроксильных
групп .в сахарозе отсутствуют свободные
полуацетальные гидроксильные группы
Эпоэтому она не способна к
цикло-оксо-таутомериии р-ры ее не мутируют
.следствием чего является отсутствие
восстановительной способности.
Вопрос 4 Валин(CH3)2-CH-CH(NH2)-COOH нейтральная (т.к. NH2-основная группа,COOH-кислая и нейтрализуют друг друга)Аспаргиновая кислотаHOOC-CH2-CH(NH2)-COOH-кислая среда;Лизин NH2(CH2)3-CH2-CH(NH2)-COOH-основная среда.
Билет 21
Вопрос 1.кетоенольная таутомерии..вид изомерии в растворе .одновременное существование в растворе изомеров ,переходящих из одного состоянияв другое.Динамическое равновесие двух форм-таутомерия.этот вид изомерии обусловлен тем,что Н+ от углевода притягивается к карбокс.кислороду в силу электроотрицательности кислорода.карбонильное соединение(кетонная форма) может существовать в равновесии с енольным изомером (енольной формой).происходит перенос протона.в монокарбонильных соединениях(альдегиды и кетоны)равновесие смещено в сторону кетонной формы.
Качественная реакция на енольную группу смотри в лекции

В опрос
2 сопряжение
–явление выравниваня связей и зарядов
в молекуле.сопряжение –это особый вид
влияния атомов п-п сопряжение пример
бутадиен 1,3;р-п сопряжение пр-р аллил-анион
СН2=СН-СН2 -Сопряженные циклические
соединения.отличаются термрдинамической
устойчивостью ,способностью вступать
в р-и замещения ,а не присоединения
,устойчивостью к действию окислителей
и тем-ры,все это обединяется общим
понятием ароматичность.циклы этих
систем по химическому строению могут
быть только углеродными или содержать
еще гетероатомыИндуктивный эффект
ЗАМЕСТИТЕЛЕЙ
Индуктивный эффект – перераспределение
электронной плотности по системе
σ–связей, вызванное разной
электроотрицательностью (ЭО) атомов.
+I эфф. имеют все R, причем для них I эфф.
меняется в следующей последовательности:
CH3 < C2H5 < (CH3)2 CH < (CH3)3C; также +I эфф.
характерен для Мe и иона О2-.–I
эфф.: Hal,
NH2,
OH,
OR,
NO2,
COOHМезомерный
эффект (М) – перераспределение электронной
плотности по системе p–связей.
М эфф., в отличие от I эфф., возникает
лишь там, где появляется сопряжение. +
М эфф.:
NH2,
OH,
OR,
Hal,
SH,
NR2
имеют гетероатом, участвующий в p-π
сопряжении. Заместитель не имеет двойной
связи. -
М эфф. – заместитель с p–связью:
опрос
2 сопряжение
–явление выравниваня связей и зарядов
в молекуле.сопряжение –это особый вид
влияния атомов п-п сопряжение пример
бутадиен 1,3;р-п сопряжение пр-р аллил-анион
СН2=СН-СН2 -Сопряженные циклические
соединения.отличаются термрдинамической
устойчивостью ,способностью вступать
в р-и замещения ,а не присоединения
,устойчивостью к действию окислителей
и тем-ры,все это обединяется общим
понятием ароматичность.циклы этих
систем по химическому строению могут
быть только углеродными или содержать
еще гетероатомыИндуктивный эффект
ЗАМЕСТИТЕЛЕЙ
Индуктивный эффект – перераспределение
электронной плотности по системе
σ–связей, вызванное разной
электроотрицательностью (ЭО) атомов.
+I эфф. имеют все R, причем для них I эфф.
меняется в следующей последовательности:
CH3 < C2H5 < (CH3)2 CH < (CH3)3C; также +I эфф.
характерен для Мe и иона О2-.–I
эфф.: Hal,
NH2,
OH,
OR,
NO2,
COOHМезомерный
эффект (М) – перераспределение электронной
плотности по системе p–связей.
М эфф., в отличие от I эфф., возникает
лишь там, где появляется сопряжение. +
М эфф.:
NH2,
OH,
OR,
Hal,
SH,
NR2
имеют гетероатом, участвующий в p-π
сопряжении. Заместитель не имеет двойной
связи. -
М эфф. – заместитель с p–связью:
Объединение p–связей понижает энергию по сравнению с молекулами с изолированными связями. Это понижение энергии называют ЭНЕРГИЕЙ СОПРЯЖЕНИЯ В сопряженных системах существует чередование двойной и одинарной связей: Циклические сопряженные системы Системы с замкнутой цепью сопряжения за счет круговой делокализации называются ароматическими. ПРАВИЛА ЗАМЕЩЕНИЯ В БЕНЗОЛЬНОМ КОЛЬЦЕ:Первый заместитель встает в любое положение и влияет на распределение электронной плотности в кольце. По влиянию на распределение электронной плотности заместители делятся на два рода. Заместители первого рода - усиливают электронную плотность в кольце, активируют реакции SЕ, орто- ,пара – ориентанты: R, CH2=CH- , OH, NHR, NR2, NH2, OR , (Cl, Br, I) Заместители второго рода – уменьшают электронную плотность в кольце, дезактивируют реакции SE, мета – ориентанты:
NH2, NHR, OH > OCH3 > C6H5, CH3 > NO2, CN, COOH, SO3H > C=0 > F, Cl, BПри наличии нескольких заместителей в бензольном кольце их действие может быть согласованным или несогласованным (влияние заместителей первого рода предпочтительнее
Вопрос 3 под липидами понимают большую группу веществ ,содер-ся в живот. И растительных тк.,не растворимых в воде и растворимых в малополярных растворителях(эфире,бензоле).в них имеются гидрофильные и гидрофобные группировки.делятся на омыляемые и неомыл-е.омыля-е липиды могут быть простыми(2компонентные) и сложные(3 и более),т.е. при гидролизе образ-ся органические соед-я 2,3 и более классов.Основа О.Л. –спирты –высшие 1атомные,3атомный спирт глицерин или 2атомные аминоспирт сфингозим спирты ацилированы высшими карбоновыми кислотами.Простые-продукт гидролиза спирт и карб.к.;сложные при гидролизе образ-ся др. в-ваполные эфиры глицерина т.е. триацилглицерины СН2О-СО-радикал
СН2О-СО-радикал1 общая формула
СН2О-СО-радикал2
Е![]()
![]() сли
радикал С17Н33 триолеоглицерин(триолеин),если
С17Н35 тристеароилглицерин(тристеарин);если
радикал С15Н31 радикал 1и 2 С17Н35 1
пальмитоилдистеароилглицерин.свойства
липиды
состатками непредельных
кислот
присоединяют по 2м связям Н2,Г,НГ,Н2О в
кис.с.окисление кислородом ненасыщ-х
гидропироксиды(радикал –О-О-Н)характеристика
высших карб кислот М б. насыщ-ми и
ненасыщ-ми (1или 2 = связи)
олеиновая1 = линоленовая(2
=);
сли
радикал С17Н33 триолеоглицерин(триолеин),если
С17Н35 тристеароилглицерин(тристеарин);если
радикал С15Н31 радикал 1и 2 С17Н35 1
пальмитоилдистеароилглицерин.свойства
липиды
состатками непредельных
кислот
присоединяют по 2м связям Н2,Г,НГ,Н2О в
кис.с.окисление кислородом ненасыщ-х
гидропироксиды(радикал –О-О-Н)характеристика
высших карб кислот М б. насыщ-ми и
ненасыщ-ми (1или 2 = связи)
олеиновая1 = линоленовая(2
=);
Линоленовая(3=)насыщенные СН3(СН2)14СООН пальмитиновая СН3(СН2)16СООН
