
Кудышкина экзамен / металлы с водой
.docx3)Взаимодействие металлов с H2O(примеры). 1. щелочные и щелочноземельные металлы легко реагируют с водой при обычной температуре с выделением водорода и образованием гидроксида; 2. менее активные металлы взаимодействуют с водой только в раскаленном виде с выделением водорода и образованием оксида. !!! Щелочные металлы – это I группа, А - главная подгруппа – Li, Na, K, Rb, Cs, Fr !!! Щелочно-земельные металлы – это II группа, А – главная подгруппа (Be, Mg не относятся) – Ca, Sr, Ba, Ra
Реакции
взаимодействия металлов с водой в общем
виде описываются
схемойMe+H2O→Me(OH)n+H2↑
Me -n(e)=Men+
(восстановитель) Е
-n(e)=Men+
(восстановитель) Е мет
2H++2(e)=H2
мет
2H++2(e)=H2 (окислитель) Е
(окислитель) Е 2Н/H2=-0,41
В
ΔE
2Н/H2=-0,41
В
ΔE =-0,41-
Е
=-0,41-
Е мет
мет 0
⟹
Е
0
⟹
Е мет
мет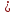 -0,41
В
-0,41
В
Реагировать с водой могут те металлы, потенциал которых менее -0,41 B. Практически в воде растворяются щелочные; Mg и щелочноземельные металлы, так как только их оксидные пленки растворимы в воде, а такие металлы, как алюминий, цинк, хром, титан, с водой не реагируют из-за явления пассивации.
Пример:
Растворение
(коррозия) Ca/CaO+H2O→
1.
CaO+H2O=Ca(OH)2
Ca+2H2O=Ca(OH)2+H2↑
2.
2Li +
2 H2O = 2 LiOH + H2 (протекает
реакция замещения)
3.
Al/Al2O3+H2O→
Al2O3+H2O→Al
не растворим в воде
(протекает
реакция замещения)
3.
Al/Al2O3+H2O→
Al2O3+H2O→Al
не растворим в воде
2) Взаимодействие с менее активными металлами, которые расположены в ряду активности от алюминия до водорода.( Mn, Zn, Fe, Co, Ni, Sn, Pb)
Реакция протекает только с парообразной водой, т.е. при нагревании.
При этом образуются: оксид этого металла и водород.
Fe + H2O = FeO + H2 (протекает реакция замещения)
Ni + H2O = NiO + H2
