
- •Типовые патологические процессы
- •4. Исход болезни.
- •По глубине поражения тканей отморожения могут быть:
- •I. По времени:
- •II. По характеру проявления:
- •2) Смена типов трофики и интенсификация обменов веществ.
- •3) Снижение регуляторной деятельности.
- •4) Разрывом корреляционных связей между клеточными компонентами, зачатками органов и тканей;
- •1. Структура митохондриальной
- •2. Функции митохондрий
- •3. Этиология и патогенез
- •4. Классификация и общая характеристика
- •5. Диагностика митохондриальных заболеваний
- •6. Лечение митохондриальных заболеваний
- •Реактивность организма
- •Категории реактивности
- •• Степень специфичности, дифференцированности ответа организма на данный фактор позволяет выделить реактивность специфическую и неспецифическую.
- •• Выраженность реакции организма на воздействиепроявляется четырьмя разновидностями реактивности: нормергической, гиперергической, гипоергической и анергической.
- •• Природа агента в зависимости от природы агента, вызывающего ответ организма, выделяют иммуногенную и неиммуногенную реактивность.
- •• Биологическая значимость ответаорганизма определяет физиологическую и патологическую реактивность.
- •Биологическая (видовая) реактивность
- •Групповая реактивность
- •Индивидуальная реактивность
- •Иммунологическая реактивность
- •Роль конституции
- •Типы конституции и болезни
- •Иммунологическая толерантность — состояние приобретенной специфической ареактивности к антигену.
- •I. Нарушение энергетического процесса, протекающего в клетке:
- •I. Ферментные антиоксидантные системы:
- •II. Неферментные антиоксиданты:
- •40. Основы оценки состояния клеток при повреждении: значение регистрации биопотенциалов, сцинтиографии, ферментометрии, показателей обмена веществ, кос.
- •1. Интраваскулярные (внутрисосудистые) расстройства
- •2. Трансмуральные («чресстеночные») расстройства
- •3. Внесосудистые (эстраваскулярные) нарушения
- •I. По этиологии:
- •II. Нейромиопаралитический механизм характеризуется:
- •1. Физиологическая
- •Селезенка
- •Конечности
- •Полости
- •I. Нейрогенные механизмы (нейротонический и нейропаралитический) развития ишемии.
- •III. Механическое звено патогенеза ишемии:
- •I. По составу:
- •III. По этиологии:
- •Дистрофия
- •Селезенка
- •Конечности
- •Полости
- •Последствия
- •Эмболия
- •1. Экзогенная (первичная, алиментарная):
- •2. Эндогенная (вторичная):
- •Отрицательный азотистый баланс — распад белка превалирует над синтезом и азота поступает в организм меньше, чем выделяется.
- •I. Экзогенное
- •II. Эндогенное
- •III. Лечебное.
- •Болезнь Гартнепа
- •1. Алиментарная (экзогенная, первичная):
- •2. Эндогенная (вторичная):
- •1. Синтез роста.
- •2. Синтез стабилизирующий.
- •3. «Регенерационный» синтез.
- •4. Функциональный синтез.
- •1. По степени увеличения массы тела:
- •2. По особенностям морфологии жировой ткани:
- •2. Гипотиреоидный механизм.
- •4. Инсулиновый механизм
- •1. Клинические:
- •2. Лабораторные:
- •2. Нарушение метаболизма гликогена:
- •1. Алиментарная:
- •4. Гликогеновая:
- •5. Печеночная:
- •6. «Почечный» диабет:
- •9. Идиопатическая
- •I. По этиологии:
- •II. По патогенезу:
- •III. По локализации дефекта:
- •6. Вирусные инфекции.
- •7. Необычные формы инсулинопосредованного диабета.
- •8. Другие генетические синдромы.
- •9. Гестационный сд.
- •Гомоцистинурия
- •Симптомокомплекс гомоцистинурии
- •Болезнь Гартнепа
- •3 Клинических типа болезни Гоше.
- •Биохимическая диагностика болезней накопления липидов
- •Гиперлипопротеидемия III типа
- •1. По этиологии:
- •2. По скорости развития:
- •3. По степени тяжести:
- •1. Нормобарическая
- •2. Гипобарическая
- •2) По локализации канцерогенного эффекта:
- •3) По числу поражаемых органов:
- •4) По химической природе:
- •2) По локализации канцерогенного эффекта:
- •3) По числу поражаемых органов:
- •4) По химической природе:
1. Нормобарическая
Причины: ограничение поступления в организм кислорода с воздухом при нормальном барометрическом давлении. Такие условия складываются при:
• Нахождении людей в небольшом и/или плохо вентилируемом пространстве (помещении, шахте, колодце, лифте).
• При нарушениях регенерации воздуха и/или подачи кислородной смеси для дыхания в летательных и глубинных аппаратах, автономных костюмах (космонавтов, лётчиков, водолазов, спасателей, пожарников).
• При несоблюдении методики ИВЛ.
2. Гипобарическая
Причины: снижение барометрического давления при подъёме на высоту (более 3–3,5 тыс. м, где pO2 воздуха снижено примерно до 100 мм рт.ст.) или в барокамере. В этих условиях возможно развитие либо горной, либо высотной, либо декомпрессионной болезни.
• Горная болезнь наблюдается при подъёме в горы, где организм подвергается воздействию не только пониженного содержания кислорода в воздухе и пониженного барометрического давления, но также более или менее выраженной физической нагрузки, охлаждения, повышенной инсоляции и других факторов средне‑ и высокогорья.
• Высотная болезнь развивается у людей, поднятых на большую высоту в открытых летательных аппаратах, на креслах-подъёмниках, а также — при снижении давления в барокамере. В этих случаях на организм действуют в основном сниженные pO2 во вдыхаемом воздухе и барометрическое давление.
• Декомпрессионная болезнь наблюдается при резком снижении барометрического давления (например, в результате разгерметизации летательных аппаратов на высоте более 10-11 тыс м). При этом формируется опасное для жизни состояние, отличающееся от горной и высотной болезни острым или даже молниеносным течением.
Патогенез: основные звенья патогенеза экзогенной гипоксии артериальная гипоксемия, гипокапния, газовый алкалоз, сменяющийся ацидозом; артериальная гипотензия, сочетающаяся с гипоперфузией органов и тканей.
При наличии во вдыхаемом воздухе высокого содержания углекислого газа экзогенная гипоксемия может сочетаться с гиперкапнией и ацидозом. Умеренная гиперкапния способствует увеличению кровообращения в сосудах мозга и сердца. Однако значительное увеличение рCO2 в крови приводит к ацидозу, дисбалансу ионов в клетках и биологических жидкостях, гипоксемии, снижению сродства Hb к кислороду и ряду других патогенных эффектов.
Гипероксическая гипоксия
1. Гипербарическая. Возникает в условиях избытка кислорода. Избыточный кислород не потребляется в энергетических и пластических целях; угнетает процессы биологического окисления; подавляет тканевое дыхание является источником свободных радикалов, стимулирующих перекисное окисление липидов, вызывает накопление токсических продуктов, а также вызывает повреждение легочного эпителия, спадение альвеол, снижение потребления кислорода, и в итоге нарушается обмен веществ, возникают судороги, коматозное состояние (осложнения при гипербарической оксигенации).
2. Нормобарическая. Развивается как осложнение при кислородной терапии, когда длительно используются высокие концентрации кислорода, особенно у пожилых людей, у которых с возрастом падает активность антиоксидантной системы.
При гипероксической гипоксии в результате увеличения парциального давления кислорода во вдыхаемом воздухе увеличивается его воздушно венозный градиент, но снижается скорость транспорта кислорода артериальной кровью и скорость потребления кислорода тканями, накапливаются недоокисленные продукты, возникает ацидоз.
Эндогенные типы гипоксии
|
|
Дыхательная гипоксия
Причина: дыхательная недостаточность, которая может быть обусловлена альвеолярной гиповентиляцией, сниженной перфузией кровью лёгких, нарушением диффузии кислорода через аэрогематический барьер, диссоциацией вентиляционно–перфузионного соотношения. Вне зависимости от происхождения дыхательной гипоксии, инициальным патогенетическим звеном является артериальная гипоксемия, обычно сочетающаяся с гиперкапнией и ацидозом.
Циркуляторная (гемодинамическая) гипоксия.
Причина: недостаточность кровоснабжения тканей и органов формирующаяся на основе гиповолемии, сердечной недостаточности, снижения тонуса стенок сосудов, расстройств микроциркуляции, нарушений диффузии кислорода из капиллярной крови к клеткам.
• Локальная циркуляторная гипоксия
Причины: местные расстройства кровообращения (венозная гиперемия, ишемия, стаз), регионарные нарушения диффузии кислорода из крови к клеткам и их митохондриям.
• Системная циркуляторная гипоксия
Причины: гиповолемия, сердечная недостаточность, генерализованные формы снижения тонуса сосудов.
Гемическая гипоксия
Причина: снижение эффективной кислородной ёмкости крови и транспортирующей кислород функции. Hb – оптимальный переносчик кислорода. Транспортная способность Hb определяется количеством кислорода, связанного с Hb, и количеством кислорода, отданного тканям. При насыщении Hb кислородом в среднем на 96% кислородная ёмкость артериальной крови (VaO2) достигает примерно 20% (объёмных). В венозной крови этот показатель приближается к 14 % (объёмным). Артерио‑венозная разница по кислороду составляет 6%.
Патогенез: главными звеньями механизма снижения кислородной ёмкости крови являются уменьшение содержания Hb в единице объёма крови и нарушения транспортных свойств Hb — т.е. анемия.
Гемический тип гипоксии характеризуется снижением способности Hb эритроцитов связывать кислород (в капиллярах лёгких), транспортировать и отдавать оптимальное количество его в тканях. При этом реальная кислородная ёмкость крови может снижаться до 5–10 % (объёмных).
1г Hb связывает 1,34 мл О2 (число Хюфнера). Исходя из числа Хюфнера, можно, зная содержание гемоглобина, вычислить кислородную емкость крови:
СO2 = 1,34×[Нb]×SO2,
где СO2 — содержание кислорода в артериальной крови; [Hb] — концентрация гемоглобина в крови; SO2 — насыщение гемоглобина кислородом; 1,34 — число Хюфнера.
Причиной уменьшения содержания кислорода в артериальной крови могут быть:
а) уменьшение концентрации гемоглобина, способного связывать кислород (уменьшение кислородной емкости крови). Это может быть обусловлено либо анемией (уменьшается общее содержание гемоглобина), либо инактивацией гемоглобина;
б) уменьшение насыщения гемоглобина кислородом. Закономерно возникает при уменьшении напряжения кислорода в артериальной крови ниже 60 мм рт.ст.
Транспортные свойства Hb нарушаются при наследственных и приобретённых гемоглобинопатиях. Причинами приобретённых гемоглобинопатий является повышенное содержание в крови метгемоглобинообразователей, окиси углерода, карбиламингемоглобина, нитроксигемоглобина.
Метгемоглобинообразователи — группа веществ, обусловливающих переход иона железа из закисной формы (Fe2+) в окисную (Fe3+). Последняя форма обычно находится в связи с OН–. Образование метгемоглобина (MetHb) — обратимый процесс. MetHb не способен переносить кислород. В связи с этим кислородная ёмкость крови снижается.
Окись углерода обладает высоким сродством к Hb. При взаимодействии окиси углерода с Hb образуется карбоксигемоглобин (HbCO), теряющий способность транспортировать кислород к тканям.
Соединения Hb (например, карбиламингемоглобин, нитроксигемоглобин) образующиеся под влиянием сильных окислителей, также снижают транспортную способность Hb и вызывают развитие гемической гипоксии.
Образование и диссоциация HbO2 во многом зависят от физико-химических свойств плазмы крови. Изменения рН, осмотического давления, содержания 2,3-дифосфоглицерата, реологических свойств снижает транспортные свойства Hb и способность HbO2 отдавать кислород тканям.
Кривая диссоциации оксигемоглобина отражает зависимость между напряжением кислорода в артериальной крови и насыщением гемоглобина кислородом (рис.1).

Рисунок 1. – Кривая диссоциации оксигемоглобина
Сдвиг кривой влево происходит при: снижении температуры; алкалозе; гипокапнии; уменьшении в эритроцитах содержания 2,3-дифосфоглицерата; отравлениях оксидом углерода (II); появлении наследственно обусловленных патологических форм гемоглобина, которые не отдают кислород тканям.
При сдвиге кривой влево гемоглобин легче присоединяет кислород в капиллярах легких, но хуже отдает его тканям.
Причиной сдвига кривой диссоциации оксигемоглобина вправо могут быть: повышение температуры; ацидоз; гиперкапния; увеличение содержания в эритроцитах 2,3-дифосфоглицерата. Влияние ацидоза и гиперкапнии на диссоциацию оксигемоглобина известно как эффект Бора. При сдвиге кривой вправо гемоглобин хуже присоединяет кислород в капиллярах легких, но лучше отдает его тканям. С этим связано защитно-компенсаторное значение эффекта Бора при кислородном голодании.
Тканевая гипоксия
Характеризуется нарушением способности тканей поглощать в нормальном объеме доставленный им кислород из-за нарушения системы клеточных ферментов в цепи транспорта электронов.
Причины: инактивация дыхательных ферментов, нарушение синтеза дыхательных ферментов, ослабление сопряженности процессов окисления и фосфорилирования при действии разобщающих факторов, повреждение митохондрий.
|
|
При тканевой гипоксии, обусловленной разобщением процессов окисления и фосфорилирования, потребление кислорода тканями может возрастать, однако превалирующее количество образующейся энергии рассеивается в виде тепла и не может использоваться для нужд клетки. Синтез макроэргических соединений снижен и не покрывает потребностей тканей, они находятся в таком же состоянии, как при недостатке кислорода.
Смешанный тип гипоксии
Причины:
• Факторы, нарушающие два и более механизмов доставки и использования кислорода и субстратов метаболизма в процессе биологического окисления. Например, острая массивная кровопотеря приводит как к снижению кислородной ёмкости крови (в связи с уменьшением содержания Hb), так и к расстройству кровообращения: развивается гемический и гемодинамический типы гипоксии.
• Последовательное влияние факторов, ведущих к повреждению различных механизмов транспорта кислорода и субстратов метаболизма, а также процессов биологического окисления. Например, острая массивная потеря крови приводит к гемической гипоксии. Снижение притока крови к сердцу обусловливает уменьшение выброса крови, расстройства гемодинамики, в том числе — коронарного и мозгового кровотока. Ишемия ткани мозга может вызвать расстройство функции дыхательного центра и респираторный тип гипоксии. Взаимное потенцирование нарушений гемодинамики и внешнего дыхания приводит к значительному дефициту в тканях кислорода и субстратов метаболизма, к грубым повреждениям мембран клеток, а также ферментов биологического окисления и, как следствие — к гипоксии тканевого типа.
Патогенез гипоксии смешанного типа включает звенья механизмов развития разных типов гипоксии. Смешанная гипоксия часто характеризуется взаимопотенцированием отдельных её типов с развитием тяжёлых экстремальных и даже терминальных состояний.
Изменения газового состава и рН крови при смешанной гипоксии определяются доминирующими расстройствами механизмов транспорта и утилизации кислорода, субстратов обмена веществ, а также процессов биологического окисления в разных тканях. Характер изменений при этом может быть разным и весьма динамичным.
Таблица 1. Основные показатели, характеризующие различные виды гипоксии

Субстратный тип гипоксии
Причины: дефицит в клетках субстратов биологического окисления. В основном глюкозы.
Патогенез субстратной гипоксии заключается в прогрессирующем торможении биологического окисления. В связи с этим в клетках быстро снижается уровень АТФ и креатинфосфата, величина мембранного потенциала. Изменяются и другие электрофизиологические показатели, нарушаются различные пути метаболизма и пластические процессы.
Ы ВЁРСТКА Вставить файл «ПФ Рис 16 06 Типичные изменения газового состава при гипоксии субстратного типа»
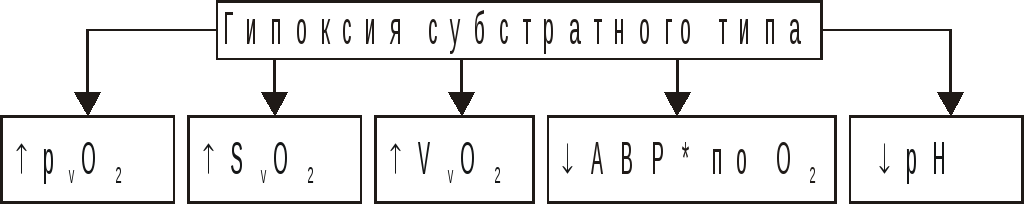
Рисунок 2. – Типичные изменения газового состава и рН крови
при гипоксии субстратного типа:
*АВР — артерио‑венозная разница по кислороду,
VvO2VaO2 – кислородная ёмкость венозной и артериальной крови,
SaO2 и SvO2 – насыщения Hb артериальной и венозной крови
Перегрузочный тип гипоксии
Причины: значительное и/или длительное увеличение функций тканей, органов или их систем. При этом интенсификация доставки к ним кислорода и субстратов метаболизма, обмена веществ, реакций сопряжения окисления и фосфорилирования не способны устранить дефицита макроэргических соединений, развившегося в результате гиперфункции клетки. Наиболее часто это наблюдается в ситуациях, вызывающих повышенное и/или продолжительное функционирование скелетных мышц и/или миокарда.
Патогенез: чрезмерная по уровню и/или длительности нагрузка на мышцу (скелетную или сердца) обусловливает: относительную (по сравнению с требуемым при данном уровне функции) недостаточность кровоснабжения мышцы; дефицит кислорода в миоцитах, что вызывает недостаточность процессов биологического окисления в них.
Ы ВЁРСТКА Вставить файл «ПФ Рис 16 07 Типичные изменения газового состава при гипоксии перегрузочного типа»

Рисунок 3. – Типичные изменения газового состава и рН крови
при гипоксии перегрузочного типа.
Нарушения функций органов и тканей ПРИ ГИПОКСИИ
Выраженность нарушений функций органов и тканей определяется:
–резистентностью органов к гипоксии;
– скоростью её развития;
– степенью и длительностью её воздействия на организм.
Нарушения ВНД
Выявляются через несколько секунд и проявляются:
– снижением способности адекватно оценивать происходящие события и окружающую обстановку;
– ощущениями дискомфорта, тяжести в голове, головной боли;
– дискоординацией движений;
– замедлением логического мышления и принятия решений (в том числе простых).
– расстройством сознания и его потерей в тяжёлых случаях.
– нарушением бульбарных функций, что приводит к расстройствам функций сердца и дыхания, вплоть до их прекращения.
Расстройства кровообращения
Проявления:
– снижение сократительной функции миокарда, уменьшение ударного и сердечного выбросов;
– расстройство кровотока в сосудах сердца и развитие коронарной недостаточности, обусловливающей эпизоды стенокардии и даже инфаркт миокарда;
– развитие аритмий сердца, включая мерцание и фибрилляцию предсердий и желудочков;
– гипертензивные реакциями (за исключением отдельных разновидностей гипоксии циркуляторного типа), сменяющимися артериальной гипотензией, в том числе – острой т.е. коллапсом);
– изменение объёма и реологических свойств крови.
Система внешнего дыхания
Проявления:
– вначале увеличением объёма альвеолярной вентиляции, а затем (при нарастании степени гипоксии и повреждения нервной системы) прогрессирующим её снижением;
– уменьшением общей и регионарной перфузии лёгких. Это обусловлено падением сердечного выброса, а также регионарной вазоконстрикцией в условиях гипоксии;
– нарушением вентиляционно‑перфузионного соотношения (вследствие местных расстройств перфузии и вентиляции в различных участках лёгких).
– снижением диффузии газов через аэрогематический барьер (в связи с развитием отёка и набуханием клеток межальвеолярной перегородки).
В итоге развивается дыхательная недостаточность, усугубляющая степень гипоксии.
Нарушения функций почек
Нарушения функций почек зависят от степени, длительности и типа гипоксии. Как правило, при гипоксии развиваются:
– расстройства диуреза (от полиурии до олиго‑ и анурии). Олигурия развивается при гипоксии, вызванной острой кровопотерей. В этом случае она является адаптивной реакцией, препятствующей уменьшению ОЦК. Олигурия наблюдается и при гемической гипоксии, вызванной гемолизом эритроцитов. В этих условиях снижение диуреза обусловлено нарушением фильтрации в клубочках почек в связи с накоплением в их капиллярах детрита из разрушенных эритроцитов. Полиурия развивается при выраженной гипоксический альтерации почек (например, у пациентов с хронической циркуляторной, дыхательной или гемической — постгеморрагической гипоксией);
– нарушения состава мочи. На различных этапах гипоксии наблюдается и повышенная плотность мочи –гиперстенурия, и пониженная – гипостенурия, и мало изменяющаяся в течение суток – изостенурия. Выраженные повреждения почек при тяжёлых формах гипоксии могут привести к развитию почечной недостаточности, уремии и комы.
Расстройства функций печени
В условиях гипоксии нарушение печеночных функций развивается, как правило, при ее хроническом течении. При этом выявляются признаки как парциальной так и тотальной дисфункции печени. К наиболее частым относятся:
– расстройства обмена веществ (углеводного, липидного, белкового, витаминов);
– нарушения антитоксической функции печени;
– угнетение образования в ней различных веществ (например, факторов системы гемостаза, коферментов, мочевины, жёлчных пигментов и др.).
Нарушения в системе пищеварения
– расстройства аппетита (как правило, его снижением);
– нарушение моторики желудка и кишечника (обычно — снижением перистальтики, тонуса и замедление эвакуации желудочного и/или кишечного содержимого);
– развитие эрозий и язв (особенно при длительной тяжёлой гипоксии).
Расстройства в системе иммунобиологического надзора
При хронических и выраженных гипоксических состояниях происходит снижение эффективности системы ИБН, что проявляется:
– низкой активностью иммунокомпетентных клеток;
– недостаточной эффективностью факторов неспецифической защиты организма: комплемента, ИФН, мураминидазы, белков острой фазы, естественных киллеров и др.
Указанные и некоторые другие изменения в системе ИБН при выраженной длительной гипоксии могут привести к развитию различных иммунопатологических состояний: иммунодефицитов, патологической иммунной толерантности, аллергических реакций, состояний иммунной аутоагрессии.
Нарушения обмена веществ в клетке при гипоксии
Гипоксия ® анаэробный гликолиз ® накапл. МК и ПК ® ацидоз ® подавление гликолиза ® нарушение работы К+/Na+- насоса ® вход в клетку Na+ ® внутриклеточный отек ® некроз
Гипоксия ® ацидоз + Са2+ ® активация лизосомальных ферментов ® усиление липолиза и протеолиза ® усиление ПОЛ ® повреждение мембран

Рисунок – 4. Расстройства обмена веществ при острой гипоксии.
экстренные и долговременные реакции адаптации
и компенсации при гипоксии
Развитие гипоксии является стимулом для включения комплекса компенсаторных и приспособительных реакций, направленных на восстановление нормального снабжения тканей кислородом. В противодействии развитию гипоксии принимают участие системы органов кровообращения, дыхания, система крови, происходит активация ряда биохимических процессов, способствующих ослаблению кислородного голодания клеток. Приспособительные реакции, как правило, предшествуют развитию выраженной гипоксии.
Экстренные и долговременные механизмы адаптации при острой и хронической гипоксии изложены в таблице 2 и таблице 3.
Таблица 2. Механизмы адаптации организма к острой гипоксии
|
Органы и системы |
Эффекты |
Механизм эффектов |
|
Система внешнего дыхания
|
Увеличение объёма альвеолярной вентиляции
|
Увеличение: - частоты и глубины дыханий - числа функционирующих альвеол
|
|
Сердце
|
Повышение сердечного выброса
|
Увеличение: - ударного выброса - числа сокращений
|
|
Сосудистая система
|
Перераспределение кровотока – его централизация
|
Региональное изменение диаметра сосудов (увеличение в мозге и сердце) |
|
Система крови
|
Увеличение кислородной ёмкости крови
|
Выброс крови из депо Элиминация эритроцитов из костного мозга Повышение сродства Hb к кислороду в лёгких Увеличение диссоциации оксигемоглобина в тканях
|
|
Система биологического окисления
|
Повышение эффективности биологического окисления
|
Активация тканевого дыхания Активация гликолиза Повышение сопряжённости окисления и фосфорилирования
|
Таблица 3. Механизмы адаптации организма к хронической гипоксии
|
Органы и системы |
Эффекты |
Механизм эффектов |
|
Система биологического окисления
|
Повышение эффективности биологического окисления |
Увеличение числа митохондрий, их крист и ферментов в них. Повышение сопряжённости окисления и фосфорилирования. |
|
Система внешнего дыхания
|
Увеличение степени оксигенации крови в лёгких
|
Гипертрофия лёгких с увеличением числа альвеол и капилляров в них. |
|
Сердце
|
Повышение сердечного выброса
|
Гипертрофия миокарда Увеличение в нём числа капилляров и митохондрий в кардиомиоцитах Возрастание скорости взаимодействия актина и миозина Повышение эффективности систем регуляции сердца
|
|
Сосудистая система
|
Возрастание уровня перфузии тканей кровью
|
Увеличение количества функционирующих капилляров Развитие артериальной гиперемии в функционирующих органах и тканях
|
|
Система крови
|
Увеличение кислородной ёмкости крови
|
Активация эритропоэза Увеличение элиминации эритроцитов из костного мозга Развитие эритроцитоза Повышение сродства Hb к кислороду в лёгких Ускорение диссоциации оксигемоглобина в тканях
|
|
Органы и ткани
|
Повышение экономичности функционирования
|
Переход на оптимальный уровень функционирования Повышение эффективности метаболизма
|
|
Системы регуляции
|
возрастание эффективности и надёжности механизмов регуляции |
Повышение резистентности нейронов к гипоксии Снижение степени активации симпатико-адреналовой и гипоталамо-гипофизарно-надпочечниковой |
Гипероксия
Гипероксия (hyper - над, сверх, oxygeniuin - кислород) - ↑ парциальное давление кислорода (рО2) в тканях организма.
Гипероксемия (hyper - над, сверх, oxygenium - кислород, haima - кровь) -↑ содержание О2 в крови.
Гипербарическая оксигенация - (греч. hyper - над. сверх, barys - тяжёлый) – насыщение организма О2 под избыточным давлением.
Гипербарическая кислородная терапия (оксигенобаротерапия) - метод лечения в барокамере основанный на применении ГБО.
Оксигенотерапия – ингаляция кислорода под нормальным (нормобарическая оксигенация) или повышенным давлением (гипербарическая оксигенация) является одним из эффективных методов лечения при некоторых тяжелых формах гипоксии.
Нормобарическая оксигенотерапия показана в тех случаях, когда парциальное давление кислорода в артериальной крови ниже 60 мм рт.ст., а процент оксигенации гемоглобина - менее 90. Не рекомендуется проводить оксигенотерапию при более высоком раО2, так как это лишь в незначительной степени повысит образование оксигемоглобина, но может привести к нежелательным последствиям. При гиповентиляции альвеол и при нарушении диффузии кислорода через альвеолярную мембрану такая кислородная терапия существенно или полностью устраняет гипоксемию.
Гипербарическая оксигенация показана при лечении больных с острой постгеморрагической анемией и при тяжелых формах отравления окисью углерода и метгемоглобинообразователями, при декомпрессионной болезни, артериальной газовой эмболии, острой травме с развитием ишемии тканей и ряде других тяжелых состояний. Гипербарическая оксигенация устраняет как острые, так и отдаленные эффекты отравления окисью углерода.
Длительно проводимая оксигенотерапия может оказать токсическое действие, которое выражается в потере сознания, развитии судорог и отеке мозга, в угнетении сердечной деятельности; в легких могут развиться нарушения, подобные таковым при респираторном дистресс-синдроме у взрослых. В механизме повреждающего действия кислорода играют роль: понижение активности многих ферментов, участвующих в клеточном метаболизме, образование большого количества свободных радикалов кислорода и усиление перекисного окисления липидов, что ведет к повреждению клеточных мембран.
|
|
Опасным до некоторой степени является применение кислородной терапии при снижении чувствительности дыхательного центра к повышению содержания СО2 в крови, что имеет место у лиц пожилого и старческого возраста с наличием церебрального атеросклероза, при органических поражениях центральной нервной системы. У таких больных регуляция дыхания происходит с участием каротидных хеморецепторов, чувствительных к гипоксемии. Устранение ее может привести к остановке дыхания.
Принципы устранения и профилактики гипоксии
Профилактика и лечение гипоксии зависят от вызвавшей ее причины и должны быть направлены на ее устранение или ослабление. В качестве общих мер применяют вспомогательное или искусственное дыхание, кислород под нормальным или повышенным давлением, электроимпульсную терапию нарушений сердечной деятельности, переливание крови, фармакологические средства. Широко используют антиоксиданты — средства, направленные на подавление свободно-радикального окисления мембранных липидов, играющего существенную роль в гипоксическом повреждении тканей, и антигипоксанты, оказывающие непосредственное благоприятное действие на процессы биологического окисления.
Устранение или снижение выраженности гипоксических состояний базируется на нескольких принципах (рис. 5):

Рисунок 5. – Принципы и методы устранения/снижения тяжести гипоксии
Основы диагностики гипоксических состояний
Газовый состав артериальной крови отражает состояние обмена газов в легких. При нарушении его наблюдается понижение напряжения кислорода (PaO2) и насыщения кислородом (SaO2). Для определения состояния обмена газов на уровне тканей параллельно нужно исследовать смешаную венозную кровь. Чем больше выражена кислородная задолжность тканей (циркуляторная гипоксия), тем больше снижены показатели в венозной крови - PvO2 и SvO2 . Такие данные свидетельствуют о необходимости оптимизации транспорта кислорода. Последний может быть недостаточен из-за сниженной кислородной емкости крови (анемия), малого сердечного выброса (гиповолемия, сердечная недостаточность) или нарушений микроциркуляции. Нередко наблюдается комбинация этих причин. Если же PvO2 и особенно SvO2 у больных в тяжелом состоянии нормальны или повышены, возникает наиболее неблагоприятная ситуация. Артериализация смешаной венозной крови наблюдается либо при наличии грубых нарушений микроциркуляции, характерных для гиповолемии, централизации кровотока при спазме артериол, либо при нарушении свойств гемоглобина. Последнее наблюдается при тяжелой гипоксии на фоне снижения в эритроцитах концентрации 2,3-ДФГ. Это явление сопровождается затруднением диссоциации оксигемоглобина и нарушением отдачи кислорода тканям. Прогноз при этом всегда неблагоприятен.
Однако определять только PO2 и SO2 не всегда достаточно, чтобы судить о кислородном балансе организма. У больных с кровопотерей, травмой, после больших операций важно знать содержание общего кислорода (концентрация общего кислорода) в крови, представленного молекулярным кислородом во всех формах (т.е. связанного с гемоглобином плюс диссоциированного в плазме), т. к. у них длительно сохраняющаяся анемия снижает кислородную емкость крови.
В определении кислородного баланса организма решающее значение придается соотношению между доставкой (транспортом) кислорода, потреблением кислорода в тканях и коэффициенту экстракции кислорода.
Нормальные значения коэффициента экстракции кислорода 26-34%. Увеличение этого показателя свидетельствует о повышенной кислородной задолженности тканей, а уменьшение - о пониженном потреблении кислорода из проходящей через ткани крови (нарушение отдачи кислорода тканям).
Для оценки степени выраженности гипоксии традиционным является определение лактата, пирувата, их соотношения, активности ЛДГ в артериальной крови. Для оценки кислородного баланса у больных требуется сопоставление многих показателей, т.к. нет единого показателя гипоксии.
ЭКСТЕМАЛЬНЫЕ СОСТОЯНИЯ (лат. extremum – чрезвычайный, предельный) — это состояния, возникающие под влиянием сильных (чрезвычайных) патогенных воздействий и характеризующиеся предельным напряжением защитных реакций организма.

Рис. 1 Этапы расстройств жизнедеятельности организма при действии патогенного фактора
К экстремальным состояниям относят: шок, коллапс, кому.
Экстремальные состояния имеют три кардинальных признака
Предельное напряжение механизмов срочной компенсации, угрожающее их срывом и необратимой декомпенсацией.
Вовлечение в процесс адаптации базисных механизмов жизнедеятельности, выходящее за пределы детерминированных алгоритмов неспецифической стресс-реакции.
Принципиальная допустимость благоприятного исхода.
Последний признак отличает экстремальное состояние организма от предтерминального, обусловленного любым длительным тяжелым патологическим процессом.
Этиология
Экстремальными называют факторы, которые дают в данных конкретных условиях и при действии на данный организм крайне высокий, предельно интенсивный, часто разрушительный эффект.
Экзогенные:
– физические: механические, электрические, термические, барометрические, радиационные, гравитационные
– химические: предельный дефицит/избыток О2, субстратов метаболизма, жидкости; тяжелые интоксикации ЛС, промышленными ядами, кислотами, щелочами
– биологические: значительный дефицит/избыток экзогенных БАВ; микробы, паразиты и грибы (токсины, продукты их метаболизма и/или распада)
Эндогенные — представляют собой неблагоприятное, тяжёлое течение болезней
– выраженная недостаточность функций органов и физиологических систем
– значительная кровопотеря, массивные кровоизлияния в органы
– избыток продуктов иммунных или аллергических реакций
– существенный дефицит/избыток БАВ и/или их эффектов
– психические перенапряжения, травмы
Условия, способствующие возникновению экстремальных состояний
Высокая температура окружающей среды при кровопотере, физическая нагрузка при сердечная недостаточность могут способствовать развитию экстремального состояния. Кроме того гипер- или гипоергическое состояние организма существенно облегчает возникновение, усугубляет течение и исходы экстремального состояния.
Сравнительная характеристика экстремальных и терминальных состояний
От экстремальных необходимо отличать терминальные состояния, которые представляют собой конечные этапы жизни организма, пограничное состояние между жизнью и смертью. Экстремальные и терминальные состояния имеют как сходные, так и принципиально отличающие их признаки.
Сходство экстремальных и терминальных состояний
– общие причины
– сходные ключевые звенья патогенеза
– пограничное положение между жизнью и смертью
– чреваты гибелью организма
– требуют неотложной врачебной помощи.
Табл.1 — Отличия экстремальных и терминальных состояний
|
Критерии |
Экстремальные состояния |
Терминальные состояния |
|
Выраженность специфики причинного фактора |
Высокая |
Патогенные эффекты фактора настолько велики, что специфика причины терминального состояния постепенно утрачивает своё значение |
|
Специфика звеньев патогенеза |
Высокая |
Разные состояния характеризуются общими ключевыми звеньями патогенеза |
|
Эффективность адаптации |
Высокая |
Низкая |
|
Обратимость |
Высокая: спонтанная, под влиянием лечения |
Спонтанно, как правило, невозможна, относительно низкая при лечении |
|
Эффективность лечения |
Высокая при коллапсах, иногда на начальных этапах шока, так как возможна активация процессов адаптации, уменьшение степени отклонений параметров гомеостаза |
Относительно низкая если не проводятся экстренные лечебные мероприятия, то терминальные состояния приобретают прогрессирующее, необратимое течение, ведущее к смерти |
ШОК (англ. shock – удар, сотрясение) — крайне тяжелое состояние организма, остро возникающее вследствие общей рефлекторной реакции на действие чрезвычайного раздражителя, характеризующееся резким уменьшением капиллярного кровотока в различных органах и угнетением всех жизненных функций в результате расстройства их нервно-гуморальной регуляции.
Виды шока
геморрагический
травматический
дегидратационный
ожоговый
кардиогенный
септический
анафилактический
Компоненты шока:
расстройство регуляции
кровоснабжения
метаболизма
Общий патогенез и проявления шоковых состояний:
– гиповолемия (абсолютная или относительная)
– болевое раздражение
– инфекционный процесс на стадии сепсиса
– последовательное включение компенсаторно-приспособительных механизмов 2-х типов:
Вазоконстрикторный тип характеризуется активацией симпатоадреналовой системы (САС) и гипофизарно-надпочечниковой системы (ГНС).
Гиповолемия абсолютная (потеря крови) или относительная (снижение МОК и венозного возврата к сердцу) приводит к снижению АД и раздражению барорецепторов, что через ЦНС активирует указанный приспособительный механизм. Болевое раздражение, сепсис, стимулирует его включение. В результате активации САС и ГНС происходит выброс катехоламинов и кортикостероидов. Катехоламины вызывают сокращение сосудов, имеющих выраженную α-адренорецепцию: кожи, почек, органов брюшной полости, что приводит к уменьшению в них кровотока. В коронарных, мозговых сосудах преобладают β-адренорецепторы → не сокращаются. Описанный механизм ведет к «централизация» кровообращения и сохранению кровотока в жизненно важных органах — сердце и мозгу, поддерживается давление в крупных артериальных сосудах. Но резкое ограничение перфузии кожи, почек, органов брюшной полости приводит к ишемии и гипоксии в этих органах.
Вазодилататорный тип включает механизмы, развивающиеся в ответ на гипоксию и направленные на ликвидацию ишемии. В ишемизированных и поврежденных тканях происходят распад тучных клеток, активация протеолитических систем, выход из клеток К+ и др. Образующиеся БАВ, вызывают:
– расширение и ↑ проницаемости сосудов
– нарушение реологических свойств крови.
Избыточное образование вазоактивных веществ приводит к неадекватности вазодилататорного типа механизмов → нарушение микроциркуляции в тканях за счет ↓ капиллярного и ↑ шунтового кровотока, изменение реакции прекапиллярных сфинктеров на катехоламины и ↑ проницаемости капилляров. Меняются реологические свойства крови, возникают «порочные круги» шок-специфические изменения МЦР и обменных процессов.
Результат этих нарушений → выход жидкости из сосудов в ткани и ↓ венозного возврата. На уровне ССС формируется «порочный круг», ведущий к ↓ СВ и ↓АД.
Болевой компонент приводит к угнетению рефлекторной саморегуляции ССС, усугубляя развивающиеся нарушения. Течение шока переходит в следующую, более тяжелую стадию. Возникают расстройства функций легких, почек, свертывания крови.
Нарушение микроциркуляции при шоке
При шоке наблюдается мозаичность местных сосудистых сопротивлений вследствие различной реактивность клеточных элементов сосудистой стенки относительно действия медиаторов воспаления со свойствами вазоконстрикторов и вазодилататоров. Кроме того, мозаичность определяется разной выраженностью микротромбоза вследствие органных фенотипических различий экспрессии тромбогенного потенциала эндотелиальной клетки.
Определяющие звенья патогенеза шока развертываются на уровне микроциркуляции. В сущности, шок представляет собой системную микроциркуляторную недостаточность. Следует учитывать, что сохраненный ток крови по макрососудам того или иного органа при шоке еще не свидетельствует о нормальном функционировании его элементов.
Вследствие
– падения возбуждения барорецепторов артериального русла, связанное с гиповолемией и падением сократимости сердца;
– циркуляторной гипоксии как причины роста уровня возбуждения хеморецепторов и соматических рецепторов скелетных мышц;
– патологической боли как причины усиления системной адренергической стимуляции развивается реакция аварийной компенсации недостаточности МОК — спазм прекапиллярных сфинктеров.
Рост сосудистого сопротивления на прекапиллярном уровне может быть эффективным механизмом аварийной компенсации, а также индуктором процессов, определяющих необратимость шока. Предельно выраженная вазоконстрикция на прекапиллярном уровне в почках (спазм приводящих артериол клубочков нефронов) служит причиной преренальной острой почечной недостаточности вследствие шока.
Вследствие спазма прекапиллярных сфинктеров и падением гидростатического давления в капиллярах возникает миграции внеклеточной жидкости в сосудистый сектор из интерстиция → аутогемодилюция для устранения дефицита объема циркулирующей плазмы.
Спазм прекапиллярных сфинктеров происходит посредством сокращения гладкомышечных элементов стенок метартериол. Спазм вызывает ишемию, обуславливающую накопление продуктов анаэробного обмена в клетках и интерстиции. Вследствие спазма прекапиллярных сфинктеров кровь, минуя обменные капилляры, поступает в венулы по метартериолам (артериоловенулярные шунты), чтобы вернуться в системное кровообращение.
В результате накопления продуктов анаэробного обмена прекапиллярные сфинктеры расслабляются, и плазма вместе с форменными элементами поступает в капилляры. Однако пройти капилляры клеткам крови не удается. Дело в том, что одновременно происходит снижение ОПСС, которое уменьшает градиент давлений между прекапиллярным и посткапиллярным уровнем микроциркуляции. Свой патологический вклад в падение градиента давлений вносит прогрессирующее угнетение сократимости сердца, обусловленное усилением метаболического ацидоза в ответ на спазм, а затем и расслабление прекапиллярных сфинктеров. Таким образом кровь задерживается в микрососудах, и гидростатическое давление в просвете обменных капилляров растет. Патологический рост гидростатического давления обуславливает миграцию жидкой части плазмы в интерстиций →обострения гиповолемии. Ишемия усиливает образование свободных кислородных радикалов → активируют эндотелиоциты, нейтрофилы, стоящие в просвете микрососудов, →воспаления. Эндотелиоциты и нейтрофилы экспрессируют на своей поверхности адгезивные молекулы. В результате происходит адгезия нейтрофилов к эндотелиальным клеткам как первый этап лишенного защитного значения воспаления. Воспаление такого происхождения является типовым патологическим процессом. Вызванное шоком системное воспаление индуцирует на периферии ряд типовых патологических процессов: системные микротромбозы, ДВС синдром, коагулопатию потребления.
В результате воспаления на периферии происходит рост проницаемости стенок микрососудов, который обуславливает выход в интерстиций плазменных белков и форменных элементов крови. Действует еще одно звено патогенеза внутренней кровопотери, вызванной шоком.
Предотвратить стаз в обменных капиллярах — основная задача неотложной терапии шока в его остром периоде. Предотвращение стаза — это предотвращение всех чреватых летальным исходом осложнений шока.
Стадии шока
Стадия компенсации (генерализованного возбуждения)
Характеризуется активация специфических и неспецифических адаптивных реакций: активация САС и гипоталамо-гипофизарно-надпочечниковой систем (ГГНС), выбросом в кровь гормонов щитовидной, поджелудочной и других эндокринных желёз. Следствием этого является гиперфункция ССС и дыхательной системы, почек, печени, других органов и тканей.
Проявления: гипертензивные реакции, тахикардия, учащение и углубление дыхания, перераспределение кровотока в разных регионах сосудистого русла, выброс крови из депо.

Рис. 2 – Основные звенья патогенеза шока (стадия компенсации)
Если процессы адаптации недостаточны, развивается вторая стадия шока.
Стадия декомпенсации (общего торможения)
На этой стадии выделяют две подстадии:
– прогрессирующую (истощение компенсаторных реакций и гипоперфузия тканей)
– необратимую (развиваются изменения, не совместимые с жизнью).
Для данной стадии характерны психическая и двигательная заторможенность, спутанность сознания, низкая эффективность нейроэндокринной регуляции, гипорефлексия, сердечная недостаточность, аритмии, артериальная гипотензия, перераспределение кровотока, капилляротрофическая недостаточность, дыхательная недостаточность, печеночная и почечная недостаточность, депонирование крови, тромбогеморрагический синдром.

Рис.3 – Основные звенья патогенеза шока (стадия декомпенсации)
Наиболее часто наблюдается декомпенсация функций почек, лёгких, печени (синдромы «шоковых почек», «шоковых лёгких» и др). В этих условиях недостаточность функции органов достигает крайней степени. Это может стать причиной смерти пациента.
«Синдром шоковых лёгких» характеризуется нарушениями микрогемоциркуляции в лёгких, отёком и обструкцией бронхиол, очаговыми ателектазами, что обусловливает острую дыхательную недостаточность.

Рис.4 – Основные звенья патогенеза «шоковых лёгких».
«Синдром шоковые почки» характеризуется значительным снижением кровоснабжения почек, тромбозами и сладжем, отёком и ишемией паренхимы, образованием цилиндров в канальцах почек. Это вызывает острую почечную недостаточность и уремию.
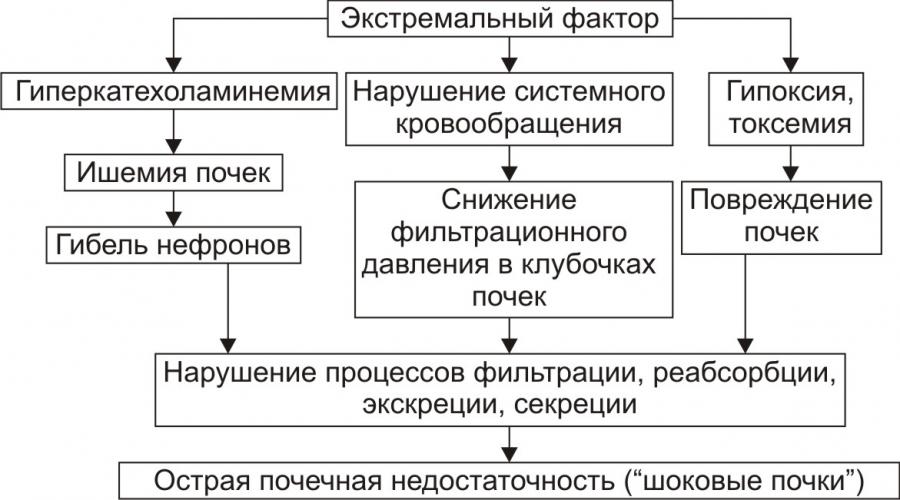
Рис.5 – Основные звенья патогенеза «шоковых лёгких»
Сходство и особенности патогенеза отдельных видов шока
Травматический шок
Причины: массированное повреждение вследствие разрыва или раздавливание тканей и органов, отрыва конечностей, перелом костей и др. Как правило, механическая травма сочетается с большей или меньшей степенью кровопотери и инфицированием раны.
В течение травматического шока выделяют эректильную и торпидную стадии.
Эректильная стадия — речевое, двигательное возбуждение; бледность кожных покровов; тахикардия; временное ↑ АД связано с активацией САС. Активация САС, особенно при наличии кровопотери, является важным компонентом общего адаптационного синдрома и процесса экстренной компенсации гипоксии.
Торпидная стадия — бледная, холодная кожа, тахикардия свидетельствуют о: продолжающейся активации САС; затемнение сознания, угнетение болевой чувствительности вследствие угнетения функций ЦНС.
Ведущие звенья патогенеза: болевое раздражение, гиповолемия
Вслед за травматическим шоком наступает период, клинически проявляющийся как полиорганная недостаточность. В последующем доминирующей причиной летальных исходов при сочетанной травме становятся тяжелые формы местной и генерализованной раневой инфекции. Значительная роль в таком развитии событий принадлежит острому вторичному посттравматическому иммунодефициту.
Геморрагический шок
– при наружных кровотечениях (ножевое, пулевое ранения, кровотечения из желудка при язве, опухолях, из легких)
– при внутренних кровотечениях
Ведущие звенья патогенеза: гиповолемия, гипоксия, болевое раздражение (во многих случаях)
Ожоговый шок
– при обширных и глубоких ожогах > 15% поверхности тела
– у детей, пожилых при меньших S
Повышение проницаемости капилляров (особенно в зоне ожога) → значительный выход жидкости из сосудов в ткани. Большое количество отечной жидкости в месте повреждения, испаряется. При ожоге 30% поверхности тела у взрослого теряется с испарением влаги до 5-6 л/сут. ОЦК падает на 20-30%.
Ведущие звенья патогенеза: гиповолемия, болевое раздражение, ↑ проницаемости сосудов
Кардиогенный шок
Часто развивается как одно из тяжелых осложнений ОИМ. Большую роль играет величина пораженной части миокарда, считается, что он всегда развивается при поражении 40% и более от массы миокарда. Может возникать при меньшем повреждении, если возникает осложнений в виде аритмии. Возможно развитие при отсутствии ИМ в случаях механических препятствий для наполнения или опорожнения желудочков (тампонада сердца, внутрисердечные опухоли)
Проявляется:
– болью (вплоть до ангинозного состояния)
–артериальной гипотензией (в отдельных случаях АД в норме)
– активацией САС
– акроцианозом
Ведущие звенья патогенеза: болевое раздражение, нарушение сократительной функций и ритма сердца. В результат нарушения сократительной функции происходит ↓СВ, ↓СИ, развивается гиповолемия, присоединение аритмии усугубляет этот процесс.
Дегидратационный шок
При значительной дегидратации в связи с потерей жидкости и электролитов или перераспределением жидкости, выходом из сосудистого русла в полости при :
– неукротимой рвоте, диарее
– выраженных экссудативных плевритах
– илеусе, перитоните
Основной патогенетический фактор гиповолемия.
Септический (эндотоксиновый) шок
Возникает как осложнение сепсиса, главным повреждающим фактором являются эндотоксины микроорганизмов.
Харктеризуется:
–лихорадкой, потрясающими ознобами с обильным потоотделением
– тахикардией, тахипноэ
– бледной кожей
– быстро прогрессирующей НК
– развитием гипотензии
– ДВС, что сопровождается ↓Tr, почечной и печеночной недостаточностью
Ведущие патогенетические звенья
– ↑ потребности организма в доставке О2 к тканям
– ↓оксигенации крови в легких и недостаточное извлечение О2 тканями из крови
– активация эндотоксинами протеолитических систем в биологических жидкостях: калликреин-кининовой, комплемента, фибринолитической.
Анафилактический шок
Развивается в ответ на повторное парентеральное введение чужеродного белка или на попадание в организм других веществ антигенной природы. Возникает внезапно, в течение нескольких минут. Эректильная стадия обычно кратковременна, проявляется чувством беспокойства, двигательным возбуждением, головной болью. Затем – спазм гладкой мускулатуры (особенно бронхов), судороги, асфиксия. Протекает тяжело, без своевременной интенсивной терапии быстро летальный исход.
Патофизиологические основы терапии шока
Этиотропный принцип заключается в прекращении воздействия повреждающего агента, применении наркоза и/или местных обезболивающих средств. Это необходимо для предотвращение патогенной афферентации от болевых и других рецепторов.
Патогенетическое лечение направлено на разрыв ключевых звеньев механизма развития шока и заключается в устранение расстройств центральной, органно-тканевой и микрогемоциркуляции, устранение (или уменьшение степени) недостаточности внешнего дыхания. При наличии признаков почечной недостаточности и развитии уремии используют аппарата «искусственная почка»
Устранение гипоксии, отклонений КОС и ионного баланса достигается, как правило, в результате нормализации функций органов. Однако, наряду с этим проводят и особые мероприятия: дыхание газовыми смесями с повышенным содержанием кислорода, гипербарическую оксигенацию, введение антиоксидантов.
С этой целью уменьшения степени токсемии проводят специальные врачебные действия: гемосорбцию и плазмафарез, ведение антидотов и антитоксинов, инъекции коллоидных растворов (адсорбирующих токсичные веществ), переливание крови, плазмы, плазмозаменителей, применяют мочегонные.
Симптоматическая терапия — направлено на уменьшение тягостных и неприятных ощущений, чувства страха, тревоги и беспокойства, обычно сопровождающие шоковые состояния. Для этого используют кардиотропные и вазоактивные вещества, дыхательные аналептики, различные психотропные средства (антипсихопатические, транквилизаторы, антидепрессанты, седативные, психостимуляторы).
КОЛЛАПС (лат. сollapsus–-ослабевший, упавший, крах, падение) — форма острой сосудистой недостаточности, возникающая в результате нарушения нормального соотношения между вместимостью сосудистого русла и ОЦК, характеризующаяся падением артериального и венозного давления и ↓ объема циркулирующей крови в сосудистой системе.
Виды коллапса
Инфекционный (тяжело протекающие острые инфекционные заболевания→ интенсивная антибактериальной терапия → гибель огромного количества микробов → высвобождение большие дозы эндотоксина → поражение нервно-мышечного аппарата стенки сосудов → атонией→коллапс)
Гипоксемический
Геморрагический
Панкреатический (в результате тяжелой травмы, сопровождающейся массивным кровоизлиянием в ткань поджелудочной железы и поступлением в кровь панкреатического сока с активными протеолитическими ферментами)
Ортостатический (при быстрой смене положения тела из горизонтального в вертикальное у пациентов, длительно соблюдающих пастельный режим. Недостаточность венозного тонуса у таких пациентов ведет перераспределению крови и резкому снижения притока крови к сердцу)
Гипертермический и другие
Основные звенья патогенеза коллапса
Быстрое падение сосудистого тонуса: при интоксикации; приеме ЛС; радиоактивном воздействии; нарушениях электролитного баланса, эндокринопатиях; гипоксии, сильном раздражении депрессорных рефлексогенных зон, угнетении прессорного отдела кардиовазомоторного центра.
Снижение ОЦК: абсолютное (ожоги, кровопотеря и др.); относительное (при правожелудочковой сердечной недостаточности, при повышении объема сосудистого русла).
Снижение сердечного выброса: ОИМ; тампонада сердца; аритмии.
Проявления и последствия коллапса
Нарушение функции ССС является инициальным и главным патогенетическим звеном коллапса и характеризуется неадекватностью кровоснабжения органов и тканей. Типичны следующие циркуляторные расстройства: сниженные ударный и сердечный выбросы крови, острая артериальная гипотензия, венозная гиперемия, перераспределение кровотока (депонирование крови в емкостных сосудах брюшной полости, лёгких, селезёнки и гипоперфузия мозга, сердца, других органов), нарушения микроциркуляции крови и лимфы, развитие капиллярно-трофической недостаточности.
Расстройство функций нервной системы проявляются заторможенность, апатия, безучастность к происходящему, тремор пальцев рук, иногда судороги, гипорефлексия, обморок при значительной гипоперфузии и гипоксии мозга.
Нарушения газообменной функции лёгких: частое и поверхностное дыхание, гипоксемия, гиперкапнии в оттекающей от лёгких крови.
Расстройство экскреторной функции почек. Так как характеризуется острой системной артериальной гипотензией → гипоперфузия почек, у пациентов часто выявляется: олигурия, гиперстенурия, гиперазотемия.
Расстройства систем крови и гемостаза: гиповолемия, повышение вязкости крови (в связи с выходом её жидкой части через стенки сосудов, проницаемость которых в условиях гипоксии увеличена), гиперагрегация тромбоцитов и эритроцитов, образование тромбов, развитие феномена сладжа.
Многие названные выше проявления коллапса обусловлены развитием гипоксии, вначале циркуляторной, а впоследствии смешанной (включая дыхательную, гемическую, тканевую, субстратную). При нарастании тяжести гипоксии могут развиться значительные расстройства жизнедеятельности организма, чреватые смертью.
Сравнительная оценка шока и коллапса
Сходство: развитие сосудистой и дыхательной недостаточности, гипоксии, компенсаторных и патологических реакций.
Табл.2 — Отличие шока от коллапса
|
Параметры |
Шок |
Коллапс |
|
Название, сущность процесса |
Нозологическая единица |
Синдром, не является нозологической единицей |
|
Этиология |
В результате раздражения экстерорецепторов |
Вызывается интоксикацией в результате раздражения интерорецепторов |
|
Наличие и преобладание основного звена в патоге-незе |
Изменения в ЦНС — первичны |
Изменения в ЦНС — вторичны. Первичны острая слабость сосудов и сердца |
|
Особенности течения |
Фазное, развивается относительно быстро |
Отсутствие фаз, развивается относительно медленно |
|
Зависимость тяжести от ↓ АД |
Прямой нет |
Прямая, критерий тяжести - ↓АД |
|
Сознание |
Сохранено/ затемнено |
Утрачено/ затемнено |
|
Изменение ОЦК |
ОЦК ↓, кровь депонируется |
Норма или снижен |
|
Наркоз и обезболивание |
В начальной стадии - профилактическое, лечебное значение |
На течение оказывают отрицательное влияние |
|
Защитно-приспособительные реакции |
Прежде - со стороны ЦНС, затем охватывают весь организм |
Одышка, ↑ЧСС, стимуляция функций кроветворных органов, мобилизация крови из депо |
Принципы терапии коллапса
Этиотропная терапия — прекращение действия экстремального фактора и/или снижению степени его повреждающего влияния: останавливают кровотечение, вводят антитоксины, антидоты, антимикробные ЛС и др.
Патогенетическая терапия — устранение или снижение степени последствий несоответствия емкости сосудистого русла и ОЦК. С этой целью пациентам вливают препараты крови, крове‑ или плазмозаменители, буферные растворы; вводят ЛС, повышающие тонус стенок резистивных и ёмкостных сосудов, активирующие функцию сердца и дыхательного центра; проводят оксигенотерапию путём вдыхания газовых смесей с высоким парциальным содержание кислорода или гипербаротерапию; при наличии признаков надпочечниковой недостаточности используют кортикостероиды.
Саногенетическая терапия — стимуляцию механизмов адаптации: активацию гемопоэза, специфических и неспецифических факторов и процессов иммунной системы, детоксицирующей и других функций печени, экскреторной способности почек.
Симптоматическая терапия — устранение тягостных, неприятных и усугубляющих состояния пациента проявлений коллапса: болевого, чувства страха смерти, подавленности, тревоги и др. С этой целью (в зависимости от конкретной ситуации) применяют антидепрессанты, нейролептики, седативные и болеутоляющие средства, психостимуляторы, транквилизаторы.
КОМА— экстремальное состояние, характеризующиеся глубоким угнетением нейронов ЦНС, проявляющееся потерей сознания, выпадением разнообразных рефлексов, отсутствием реакции на внешние раздражители, глубокими нарушениями дыхания, кровообращения и метаболизма.
Виды коматозных состояний
Неврологические комы в связи с первичным поражением ЦНС, развивающиеся при инсультах, ЧМТ, воспалениях и опухолях головного мозга и его оболочек.
Эндокринологические комы, возникающие как при недостаточности некоторых желез внутренней секреции (диабетическая, гипокортикоидная, гипопитуитарная, гипотиреоидная комы), так и при их гиперфункции (тиреотоксическая, гипогликемическая);
Токсические комы, возникающие при эндогенных (уремия, печеночная недостаточность, токсикоинфекции, панкреатит) и экзогенных (отравления алкоголем, барбитуратами, фосфорорганическими и другими соединениями) интоксикациях;
Гипоксические комы, обусловленные нарушениями газообмена при различных видах кислородного голодания.
Этиологические факторы коматозных состояний
Экзогенные:
– травмирующие факторыры (как правило, головной мозг) например электрический ток, механическая травма
– термические (перегревание, солнечный удар, переохлаждение)
– гипо- и гипербария
– нейротропные токсины (алкоголь или его суррогаты, токсичные дозы наркотиков, седативные, барбитураты)
– инфекционные агенты (нейротропные вирусы, ботулинистический и столбнячный токсины, возбудители малярии, брюшного тифа, холеры)
– экзогенная гипоксия и аноксия
– лучевая энергия (большие дозы радиации)
Эндогенные:
– патологические процессы в мозге (ишемия, инсульт, опухоль)
– нарушение кровообращения и дыхания
– патология системы крови (массивный гемолиз эритроцитов, выраженная анемия)
– эндокринопатии (гипоинсулинизм, надпочечниковая недостаточность)
–нарушения системы пищеварения (синдром мальабсорбции, кишечная аутоинтоксикация)
– почечная и печёночная недостаточность
Стадии комы
Начальная — психическое беспокойство
Прекома — спутанность сознания
Неглубокая кома
Глубокая кома — полная утрата сознания, арефлексия, вегетативные расстройства
Общий патогенез коматозных состояний
Кома является далеко зашедшей стадией развития ряда заболеваний, когда ведущим в их патогенезе становится поражение центральной нервной системы. Особую роль в развитии комы играют нарушение функции ретикулярной формации с выпадением активирующего влияния на кору головного мозга и угнетение функции подкорковых образований и центров вегетативной нервной системы.
Ведущие патогенетические звеньями комы: гипоксия мозга, ацидоз, нарушения баланса электролитов и образования и выделения медиаторов в синапсах ЦНС, расстройство мозгового кровообращения, ликвородинамические нарушения.
Морфологически эти нарушения проявляются в виде набуханий и отека мозга и мозговых оболочек, мелких кровоизлияний и очажков размягчения.

Рис.6 — Основные звенья патогенеза коматозных состояний
Патогенез гипергликемической кетоацидотической комы
Дефицит инсулина и преобладание эффектов контринсулярных гормонов→ неэффективность или блокировка всех путей метаболизма ацетил-КоА, кроме тех которые ведут к образованию кетоновых тел (КТ) → гиперкетонемия.
Гиперкетонемия →↑ Росм межклеточного пространства → внутриклеточная дегидратация.
Гиперкетонемии → кетоацидоз → угнетение гликолиза → лактат ацидоз.
Угнетение гликолиза →↓ 2,3-дифосфоглицерата →↑сродства Hb к О2 и ↓диссоциации → гипоксия.
Глюкоза, КТ (связывающие ионы Na+) выводятся с мочой → ↑ Росм первичной мочи → потеря ионов Na+ и полиурия →внеклеточная дегидратация (гиповолемия) → гемоконцентрация.
Гемоконцентрация → недостаточность периферического кровообращения вплоть до гипотензии. Сердечные аритмии (вследствие потери электролитов с мочой) способны усугубить недостаточность кровообращения →→ гипоксия
Вследствие ↑ катаболизма белков → ↑↑ аммиак и мочевина→ гиперазотемия, но из-за дефицита кетокислот используемых для ГНГ в мозгу ↓ способность к нейтрализации аммиака → токсическое действие на нейроны.
Гипоксия пневмотаксического центра→ дыхание Куссмауля (редкое, глубокое, шумное) → потеря СО2→ истощение НСО3-.
В целом гипоксия нейронов приводит к расстройству дыхания, сосудистому коллапсу, снижению мышечного тонуса, нарушению ВНД.
Патогенез гипогликемической комы
Дефицит глюкозы → снижение выработки АТФ → снижение активности Na+/K+ и Ca2+ / Mg2+ насосов → утрата ионных градиентов → деполяризация клеток ЦНС → клонические судороги (имеют определенное компенсаторное значение из-за гликогенолиза в мышцах и усиления поступления лактата в ГНГ).
Нарушения функций организма при коматозных состояниях
Нервная и эндокринная системы: расстройства сознания, потеря сознания, гипо‑ и арефлексия, дисбаланс БАВ и их эффектов.
ССС: сердечная недостаточность, аритмии, артериальная гипотензия и коллапс, перераспределение кровотока, капилляротрофическая недостаточность.
Лёгкие: дыхательная недостаточность.
Система крови и гемостаза: депонирование крови, изменение вязкости крови, тромбогеморрагический синдром.
Печень: печёночная недостаточность.
Почки: почечная недостаточность.
Пищеварение : недостаточность полостного и мембранного пищеварения, кишечная аутоинтоксикация, аутоинфекция.
Принципы терапии коматозных состояний
Этиотропное лечение является основным. В связи с этим принимают меры для прекращения или ослабления патогенного действия причинного фактора. Например, при
коме, вызванной интоксикацией организма применяют: специфические антидоты. При коме инфекционного происхождения: применяют антибактериальные средства (антибиотики, сульфаниламиды, а также антисептики, действующие на флору кишечника и мочевыводящих путей).
Патогенетическая терапия включает мероприятия, направленные на блокаду, устранение и/или снижение повреждающих эффектов основных звеньев патогенеза комы: гипоксии, интоксикации, расстройств КОС, дисбаланса ионов и жидкости, БАВ и их эффектов.
Симптоматическая терапия направлена на оптимизацию функций органов и их систем, устранение судорог, боли, тягостных ощущений в пре‑ и посткоматозном состояниях. С этой целью применяют: противосудорожные средства, болеутоляющие вещества (включая наркотические), кардиотропные и вазоактивные препараты, дыхательные аналептики.
Учитывая, что кома характеризуется тяжёлыми расстройствами функций органов, их систем, механизмов регуляции организма, эффективность терапевтических мероприятий должна контролироваться постоянной регистрацией состояния жизненно важных функций, сознания и параметров гомеостаза.
Методы диагностики нарушений в организме при типовых формах экстремальных состояний
Критерии шока и его тяжести
АД
Шоковый индекс (ШИ, индекс Альговера) представляет собой отношение ЧСС в минуту к величине систолического АД. Используя ШИ можно оценить степень кровопотери.
ЦВД
Сердечный выброс (CВ)
-Давление заклинивания в легочной артерии (ДЗЛА) определяется методом катетеризации
ОПСС
Диагностика коматозных состояний
Выбор методов лабораторной и инструментальной экспресс-диагностики определяется этиологией комы. Например, при диабетической коме определяют уровень глюкозы, осмолярность, кетоновые тела, электролиты; при уремической — мочевину, креатинин и тд.
Для оценки глубины нарушения сознания используют шкалу Глазго (у взрослых)
В целом методами лабораторной экспресс-диагностики в крови определяют следующие параметры — ОАК, Ht, глюкозу, осмолярность, седативные и токсические вещества, электролиты, мочевину, креатинин, функциональные пробы печени, коагуляционные свойства крови. В артериальной крови определяют параметры КОС.
В спинномозговой жидкости — цитоз, белок,глюкозу.
В моче — ОАМ, кетоновые тела, глюкозы, седативные препараты, снотворные.
Инструментальные экспресс-методы
– ЭхоЭС (энцефалоскопия)
– люмбальная пункция для выявления повышенного ВЧД и наличия кровоизлияний
– КТ, МРТ головного мозга
– электроэнцефалография (ЭЭГ)
– ЭКГ
СТРЕСС (от англ. stress – напряжение) — неспецифическая стереотипная приспособительная реакция организма на действие раздражителей чрезвычайной силы и любой природы.
Основные группы стрессоров
Средовые
– физические воздействия — боль, холод, перегрев
– биологические — инфекционные агенты
– химические
2. Психоэмоциональные (увеличение информационной нагрузки, в том числе неприятной; информационный дефицит)
3. Социальные (конфликтные ситуации, сдерживание эмоции и отсутствие двигательных реакций в ответ на стрессор, не соответствие амбиции социальному или профессиональному статусу).
Информационная триада
Длительное пребывание мозга в условиях неблагоприятного сочетания следующих факторов:
1) определенного объема информации, подлежащей обработке для принятия важного решения;
2) фактора времени, отведенного для такой работы мозга;
3) уровня мотивации, который и определяет значимость информации и необходимость ее обработки.
может привести к нарушению высших функциях НС и опосредовано к нарушению жизнедеятельности других систем организма
Сочетание трех факторов может быть неблагоприятным, если:
–необходимо обработать большой объем информации (включая принятие решения) при длительном дефиците времени, отведенного для такой работы мозга, и высоком уровне мотивации поведения.
– имеет место дефицит информации в течение длительного времени, а мотивация поведения (например, необходимость принятия решения) очень высокая.
Виды психогенного стресса
Нормостресс обеспечивает длительную работу мозга в условиях постоянно изменяющейся или монотонной среды, позволяет выработать и удержать в рабочей готовности необходимый уровень активности мозговых функций.
Гиперстресс возникает под влиянием сверхсильных раздражителей и по своему биологическому значению может быть биологически положительным или отрицательным. Две эти формы гиперстресса определяются уровнем развития адаптационных механизмов, прежде всего механизма саморегуляции. Состояние гиперстресса, при достаточном уровне развития защитных механизмов, возвращается в коридор нормостресса, или возникают новые границы нормостресса (при постоянном действии факторов, вызвавших состояние гиперстресса). В противном случае развивается состояние отрицательного гиперстресса — условия возникновения и формирования патологии.
Гипостресс. У людей в состоянии гипостресса наблюдается низкий порог привыкания к алкоголю, к наркотическим веществам.
К показателям, позволяющим выделять 3 основные формы стресса, относятся и эффективность профилактических мер. Так, студенты-первокурсники в период экзаменационной сессии по ряду признаков были разделены на группы нормо- и гипостресса. Последняя группа, как правило, не справлялась с влияниями информационной триады; возникали симптомы, указывающие на целесообразность прекращения или перерыва учебы. У этих студентов резко повышалась общая двигательная активность (что понималось как «неусидчивость», лень, отсутствие интереса к учебе и т.д.). Между тем совокупность наблюдений дала основание рекомендовать применение интенсивных мышечных нагрузок. В этих случаях у 70% студентов из группы гипостресса имело место улучшение психического и физического самочувствия, а главное — существенно возрастала результативность решения психических задач.
Стадии стресса
Согласно концепции Г. Селье, стресс неоднороден. Он имеет как адаптивную природу (отсюда его синоним «общий адаптационный синдром»), так и предпатологическую, которая реализуется при наступлении стадии истощения.

Рис. 7— Стадии стресса
Стадия тревоги
Включает две подстадии:
«шок» — характеризуется кратковременным снижением резистентности к патогенному фактору,
«противошок» — характеризуется восстановлением и последующим повышением сопротивляемости организма.
Стадия резистентности — характеризуется стойким и длительным увеличением сопротивляемости организма как к фактору, вызвавшему стресс, так и к другим патогенным агентам.
Стадия истощения — наступает при действии раздражителей, превышающих функциональные ресурсы нейроэндокринного аппарата, а также в условиях функциональной слабости адаптационных механизмов. Сопровождается уменьшением резистентности организма к патогенным воздействиям. В третьей стадии употреблять термин «общий адаптационный синдром» не вполне уместно.
В зависимости от силы воздействия стрессоров и степени выраженности вызванных изменений Г. Селье предложил различать:
эустресс — состояние напряжения адаптационных резервов организма, вызванное раздражителями умеренной силы, которое (является физиологическим состоянием, тренирует, укрепляет адаптационные системы организма);
дистресс — состояние, вызванное сильными и продолжительными стрессорными воздействиями, исходом которого могут быть выздоровление, возникновение хронического заболевания или же смерть.
Механизмы развития стресса, роль нервно-гормональных факторов
При стрессе гипоталамус может активироваться не только нервными влияниями, но и гуморальными факторами: гипоксией, гипогликемией, интерлейкинами (IL-1, IL-6), фактором некроза опухолей (TNF), интерфероном (IFN) (т.е. при инфекциях, лихорадке, сепсисе и др. может осуществляться цитокиновая регуляция стресса).
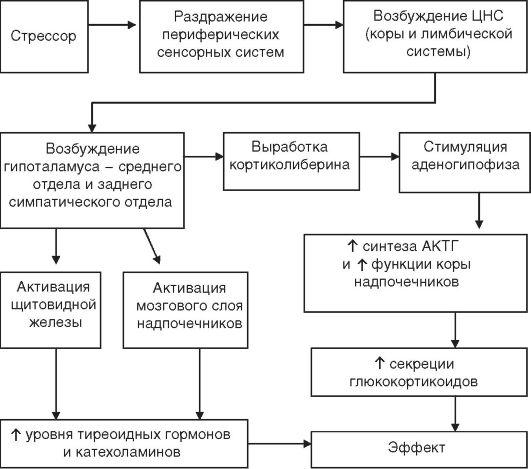
Рис. 8— Патогенез стресса
Механизмы положительного и негативного действия гормонов стресса
Уже в начальной стадии тревоги в в гипоталамусе увеличивается выработка кортиколиберина и гипоталамических нейропептидов (предшественников вазопрессина и окситоцина), обладающих следующими эффектами:
– кортиколиберин активирует центр страха и тревоги, вызывает анорексию и усиливает двигательную активность, стимулирует САС, повышает АД и увеличивает синтез АКТГ, может стимулировать лимфоцитарную продукцию эндорфинов;
– АКТГ стимулирует кору надпочечников, повышает синтез СТГ, активирует липолиз, увеличивает транспорт аминокислот в мышцы, снижает распад глюкокортикоидов в печени, в результате чего удлиняется время их циркуляции в крови. В ЦНС АКТГ влияет на поведенческие реакции: усиливает тревогу и страх, подавляет половое влечение, повышает кратковременную память.
Таким образом, кортиколиберин и АКТГ стимулируют центры страха и тревоги в лимбической системе, что создает характерный эмоциональный фон в начальной стадии стресса.
– вазопрессин задерживает воду и сохраняет ОЦК, что важно при кровотечениях; вызывает констрикцию сосудов кожи и мышц, а в больших дозах — коронарных сосудов (в связи с чем он является фактором риска сердечно-сосудистой патологии при стрессе), усиливает распад гликогена, активирует липогенез в адипоцитах, способствуя поглощению «излишней» глюкозы и избытка жирных кислот. Стимулирует память, снижает ответ ЦНС на боль.
– окситоцин стимулирует иммунный ответ, обладает инсулиноподобным действием на жировую ткань (аналогично антидиуретическому гормону — АДГ).
– тиреоидные гормоны увеличивают основной обмен и способствуют развитию гипергликемии, повышают катаболизм белка, усиливают липолиз, что способствует кетоацидозу; увеличивают диурез, повышают возбудимость ЦНС и симпатической нервной системы, в результате чего могут отмечаться тахикардия и гипертония. Продукты распада тиреоидных гормонов обладают свойствами катехоламинов.
– гормоны надпочечников
Метаболический эффект — изменение углеводного, белкового, липидного и других обменов с целью мобилизации энергетических ресурсов в активно работающие органы: сердце, мозг, отчасти в печень, почки:
изменения углеводного обмена — глюкокортикоиды и катехоламины снижают захват глюкозы инсулинозависимыми тканями и органами (скелетные мышцы, органы ЖКТ, жировая ткань). Одновременно повышается доступность глюкозы для сердца, мозга, почек, эритроцитов — их клетки имеют как инсулинозависимые, так и инсулинонезависимые системы захвата и метаболизма глюкозы, стимулируют глюконеогенез.
изменения белкового обмена — глюкокортикоиды увеличивают синтез белка в сердечной мышце, печени, в органах ЦНС, но одновременно снижают синтез белка и повышают его распад в коже, костях, скелетных мышцах, в лимфоидной и жировой ткани.
изменения жирового обмена — глюкокортикоидов активируют липолиз, освобождая из подкожной жировой клетчатки, легких и костного мозга неэтерифицированные жирные кислоты, используемые сердечной и скелетными мышцами, а также почками как энергетические субстраты.
Эффекты гормонов надпочечников
ССС. Повышается сосудистый тонус, частота пульса, сердечный выброс, увеличиваются ОЦК, АД и скорость кровотока (например, повышаются кровенаполнение сосудов мозга и линейная скорость кровотока в них), что активизирует транспорт О2 и субстратов к тканям. Выброс катехоламинов стимулирует секрецию почками ренина, участвующего в механизме развития артериальной гипертензии при стрессе.
Дыхательной система. Адреналин расширяет бронхи и улучшает их проходимость; норадреналин вызывает констрикцию сосудов слизистой дыхательных путей и уменьшает секрецию слизи. Результатом совместного действия глюкокортикоидов и катехоламинов являются гипервентиляция и повышение образования сурфактанта, облегчающего расправление альвеол и повышающего эффективность внешнего дыхания.
Система крови и иммунная система. При избытке глюкокортикоидов активируются эритропоэз и тромбоцитопоэз, увеличивается число нейтрофилов, моно- и лимфоцитопоэз при этом угнетаются. В крови развивается лимфопения, а также эозинопения, что приводит к угнетению клеточного и гуморального иммунитета; подавляется фагоцитоз, снижается синтез антител, уменьшается продукция цитокинов.
Противовоспалительное действие глюкокортикоидов связано с тем, что они стабилизируют мембраны клеток и клеточных органелл, снижают проницаемость сосудистых стенок, тормозят выход из клеток медиаторов воспаления, стимулируют антиоксидантные системы, инактивируют ферменты арахидонового каскада (снижая образование простагландинов и лейкотриенов), ингибируют экспрессию молекул межклеточной адгезии, что угнетает эмиграцию лейкоцитов из сосудов в очаг воспаления. Являясь антипиретиками, глюкокортикоиды препятствуют развитию лихорадки. Способны индуцировать в активированных лимфоцитах и эозинофилах эндонуклеазы, вызывая апоптоз этих клеток. В результате из организма удаляются активированные антигенами лимфоциты, что подавляет деструктивный компонент иммунного ответа. В экспериментах при ингибировании данного эффекта крысы умирали от разлитого воспаления, индуцированного цитокинами лимфоцитов. Длительное воздействие глюкокортикоидов может вызвать вторичный иммунодефицит. Отрицательные последствия их избыточной продукции становятся особенно значимыми в условиях хронического стресса, что приводит к развитию болезней адаптации.
Основные проявления стресса
Г. Селье пронаблюдал и описал многообразные изменения, возникающие в организме при стрессе и называемые в настоящее время триадой Селье.
«триада Селье при остром стрессе»:
Гипертрофия коры надпочечников
Инволюция тимико-лимфоцитарной системы (атрофия вилочковой железы и лимфатических узлов, селезенки), изменения в периферической крови в виде нейтрофильного лейкоцитоза, снижения количества лимфоцитов и эозинофилов.
Образование геморрагических язв в желудочно-кишечном тракте.
Реакция тревоги
Длится от 6 до 48 ч после действия стрессора.
Вначале характеризуется снижением АД, уменьшается ЧД и ЧСС, снижаются температура тела, тонус скелетных мышц, содержание глюкозы в крови, повышается проницаемость стенок капилляров, сгущается кровь, что сопровождается распадом белков и преобладанием катаболических реакций.
Вследствие включения механизмов противодействия повреждению:
– начинается мобилизация общих защитных сил организма, что связано в основном с усилением притока к тканям энергетических субстратов (глюкозы и жирных кислот);
– возрастает секреция адренокортикотропного гормона (АКТГ) и глюкокортикоидных гормонов (кортизола, кортикостерона), эндогенных опиоидов;
– учащаются дыхание, сердцебиение, повышаются температура тела, уровень глюкозы и ненасыщенных жирных кислот в крови, уменьшается содержание гликогена в печени;
– восстанавливаются кровоснабжение, доставка питательных веществ и кислорода в мозг, сердце, скелетные мышцы.
Отмечается инволюция тимико-лимфатического аппарата, появляются геморрагические высыпания и изъязвления на слизистой желудка и двенадцатиперстной кишки, что связано с активацией мозгового слоя и коры надпочечников и выбросом в кровь катехоламинов и глюкокортикоидов. Эрозивные изменения и возникновение язв ЖКТ обусловлены способностью глюкокортикоидов стимулировать секрецию НСl и пепсина.
Устойчивость организма к повреждающему фактору на стадии тревоги временно снижается.
Стадия резистентности
Наступает через 48 ч после действия стрессора.
Стресс, вызванный одним раздражителем, на этой стадии повышает устойчивость организма к действию любых других раздражителей. Картина, наблюдаемая на данной стадии, лучше всего соответствует понятию общего адаптационного синдрома.
Для этой стадии характерным признаком является гипертрофией коры надпочечников с устойчивым повышением секреции глюкокортикоидов, что обычно способствует повышению устойчивость организма к действию чрезвычайных раздражителей. Этот эффект связан с непосредственным действием кортикостероидов и со способностью их активировать адаптационно-трофическое влияние симпатической нервной системы. В стадии сохраняется усиленная секреция катехоламинов в мозговом слое. Отмечаются также гиперплазия щитовидной железы и некоторая атрофия гонад, уменьшается скорость роста тела (у детей и подростков), может прекратиться лактация у кормящих женщин.
Если действие стрессора прекращается или оно незначительно по своей силе, вызванные им изменения постепенно нормализуются. Происходит восстановление морфологии и функции органов до нормы. Однако если влияние патогенного фактора оказывается чрезмерно сильным или длительным, развивается истощение функции коры надпочечников и наступает снижение резистентности к данному и другим раздражителям. Усиливаются катаболические и некротические изменения в органах и тканях.
Стадия истощения
На этой стадии устойчивость к вредному фактору вновь снижается, и в организме появляются изменения, похожие на те, что происходят при старении. При перенапряжении какой-либо функции она может оказаться неадекватной условиям и стать источником дальнейших нарушений. Например, перенапряжение процесса возбуждения в коре головного мозга может привести к развитию запредельного торможения, которое само становится причиной различных расстройств.
Механизмы реализации стресс-лимитирующих факторов.
Центральная стресс-лимитирующая система
1. ГАМК-ергическая система представлена γ-аминомасляной кислота (ГАМК) и γ-оксимасляной кислотой (ГОМК). Тормозит чрезмерное возбуждение адренергической и гипофизарно-адреналовой системы.
2. Опиатергическая система представлена эндорфинами и энкефалинами. Их действие опосредуется через пять видов опиатных рецепторов. Они обусловливают аналгезию и эйфорию, уменьшают тревожность, стимулируют аппетит, формируют чувство удовольствия и радости при утолении голода, нормализуют и даже снижают артериальное давление, препятствуют стрессорной активации сердечной деятельности, угнетают секрецию желудка и моторику желудочно-кишечного тракта, тормозят синтез глюкокортикоидов и катехоламинов. Стимулируют функции цитотоксических лимфоцитов и образование антител.
3. Дофаминергическая система подавляет механизмы стресса, однако есть и косвенные данные о стимулирующей роли дофаминергических нейронов ядер шва в развитии стресса.
4. Серотонинергическая система. Роль серотонинергической системы в ограничении стресс-реакций недостаточно ясна. Имеются данные об ее активирующей роли при стрессе.
5. Эпифиз стимулирует продукцию эндогенных опиатов, и его недостаточность у пожилых людей снижает стресс-резистентность организма, с возрастом также уменьшается секреция эпифизарного мелатонина, являющегося активатором антиоксидантной системы организма.
6. Мелатонин и норадреналин, вырабатываемый нейронами центра удовольствия в гипоталамусе, ингибируют запуск механизмов стресса. Кроме того, мелатонин и серотонин ответственны за циркадный ритм секреции кортиколиберина — стартового гормона стресса.
Периферическая стресс-лимитирующая система
1. Простагландины (Е и А) являясь вазодилататорами снижают АД, ограничивают липолитическое действие катехоламинов и уменьшают выход в кровь СЖК, простагландины Е тормозят выход норадреналина из пресинаптических терминалей и уменьшают его уровень, снижая возбуждение симпатической системы. При этом сами катехоламины стимулируют образование простагландинов, действуя через β-адренорецепторы и повышая образование цАМФ или активируют калликреин-кининовую систему и образующийся брадикинин через фосфолипазу А1 высвобождает арахидоновую кислоту, из которой синтезируются простагландины. Таким образом, адренергическая стимуляция тканей приводит к активации синтеза простагландинов, которые по механизму обратной связи ограничивают действие катехоламинов.
2. Антиоксиданты — это клеточные системы защиты от повреждения свободными радикалами: аскорбиновая кислота; супероксиддисмутаза; каталаза; глутатионпероксидазы и др. Их защитный эффект связан не только с предотвращением активации перекисного окисления липидов (ПОЛ) в органах-мишенях, где реализуется эффект высоких концентраций катехоламинов.
3. Аденозин в сердце препятствует развитию стрессорной вазоконстрикции, вызываемой катехоламинами, АДГ, ангиотензином, тромбоксаном А2. Под влиянием аденозина ограничивается кардиотоксический эффект избытка катехоламинов. Как первое, так и второе достигается благодаря торможению аденозином избыточного транспорта Ca2+ в кардиомиоциты. Повышенная концентрация Ca2+ в саркоплазме кардиомиоцитов вызывает разобщение окисления и фосфорилирования в митохондриях, генерацию свободных радикалов, активацию фосфолипаз, контрактуру миофибрилл, гипергидратацию клеток.
4. Белки теплового шока (heat shock protein — HSP). HSP взаимодействуют с рецепторами стероидных гормонов, предохраняя клетки от избыточной стимуляции при стрессе. HSP-шапероны предохраняют область ядра от мутаций, препятствуют агрегации и денатурации белков в условиях стресса. Низкомолекулярные HSP (убиквитины) являются рецепторами для специфических протеаз и способствуют удалению поврежденных белковых молекул, прикрепляясь к ним. Шапероны подавляет сигнальные пути активации апоптоза, убиквитины, индуцируют программу клеточной смерти.
Защитно-приспособительное значение стресса
Формирование неспецифической резистентности организма к патогенным агентам независимо от их природы (за счет гиперемии, фагоцитарной инфильтрации, тромбоза капилляров и др. в очаге повреждения).
Патогенное значение стресса и понятие о болезнях «адаптации».
Вследствие чрезмерной секреции глюкокортикоидов подавляется развитие неспецифических защитных реакций (воспаление), и тогда попавшие в организм микроорганизмы получат возможность беспрепятственно размножаться, что может привести к сепсису.
На клеточном уровне неизбежными компонентами стресса являются:
– активация свободнорадикального и перекисного окисления липидов и белков, индуцируемая высокими концентрациями катехоламинов (оксидативный стресс);
– повреждение или структурно-функциональная модификация клеточных мембран и органелл образующимися в избытке свободными радикалами (клеточный стресс);
– дестабилизация лизосомальных мембран и высвобождение протеолитических ферментов в цитоплазму и плазму крови и как результат — ферментемия;
– образование митохондриальных пор с выходом из митохондрий их содержимого.
Болезни «адаптации» или стресс – болезни.
Например, дуоденальная язва, иммунодефициты, онкозаболевания, ожирение, сахарный диабет, остеохондроз, артриты, артериальная гипертензия, импотенция, бесплодие.
Появляются, когда приспособительная реакция организма становится неадекватной и выступает в роли патогенного фактора. Например, избыток стероидных гормонов при частых и интенсивных стрессах может способствовать возникновению поражений ЖКТ (стероидная язва). Экспериментально доказано, что стресс ускоряет рост новообразований, повышает частоту метастазирования, улучшает перевиваемость опухолей. Кроме того, хронический стресс вызывает нервно-психические расстройства (депрессию, тревогу, утомляемость). При функциональная недостаточностью ГГНС или САС стадия резистентности может отсутствовать, тогда возможно быстрое наступление дистресса.
Методы оценки стресс-реакции
Измерение уровня кортикостероидов. Уровень активности кортикостероидов оценивают по конечному метаболиту 17-гидроксикортикостерону (17-ГОКС). Содержание 17-ГОКС измеряют в моче и крови хроматографически.
Измерение содержания в крови катехоламинов
Электромиографические методы позволяют оценить влияние стресса на тонус поперечно-полосатой мускулатуры.
Измерение показателей гемодинамики с помощью плетизмографии.
Электрокожные методы — оценка влияния стресса на электрические характеристики кожи, меняющиеся в зависимости от ее кровенаполнения и влажности (кожно-гальваническое сопротивление, кожный потенциал).
Психологические методы (преимущественно тесты).
Принципы коррекции стресса.
Фармакологическая коррекция базируется на принципах оптимизации функций систем, инициирующих стресс-реакцию под действием чрезвычайного фактора и предупреждении, уменьшении и/или устранении изменений в тканях и органах в условиях стресс‑реакции.
Оптимизация функций стресс-инициирующих систем организма (САС, ГГНС).
У различных индивидов исходный уровень активности указанных систем и характер реагирования на разные стрессорные агенты, различны. В связи с этим возможно развитие неадекватных реакций: либо чрезмерных, либо недостаточных. В большой мере выраженность этих реакций зависит от эмоционального восприятия ситуации.
Для предупреждения неадекватных стрессорных реакций применяют различные классы транквилизаторов. Последние способствуют устранению состояния психастении, раздражительности, напряжённости, страха. Благодаря этому, указанные препараты предупреждают развитие неадекватных по выраженности, длительности и характеру стресс‑реакций.
С целью нормализации состояния САС и ГГНС используют препараты:
– блокирующие их эффекты (адренолитики, адреноблокаторы, «антагонисты» кортикостероидов);
– потенцирующие их (катехоламины, глюко- и минералокортикоиды).
Коррекция процессов, развивающихся в тканях и органах при стресс-реакции:
– активация центральных и периферических антистрессорных механизмов (применением препаратов ГАМК, антиоксидантов, Пг, аденозина или стимуляцией их образования в тканях
– блокирование механизмов повреждения клеток и неклеточных структур (нарушений энергообеспечения, альтерации мембран и ферментов, дисбаланса ионов и воды, изменений генетической программы клеток и механизмов её реализации, расстройств местных механизмов регуляции.
Опухоль - это типовое нарушение тканевого роста, проявляющееся в бесконтрольном размножении клеток, которые характеризуются атипизмами, или анаплазией.
Под атипизмами понимают совокупность признаков, отличающих опухолевую ткань от нормальной и составляющих биологические особенности опухолевого роста.
Анаплазия - термин, подчеркивающий сходство опухолевой клетки с эмбриональной (усиленное размножение, интенсивный процесс гликолиза и др.). Но, опухолевые клетки не тождественны эмбриональным: они растут, но не созревают (не дифференцируются), способны к инвазивному росту в окружающие ткани с разрушением последних и т.д.
Основные биологические атипизмы доброкачественных и злокачественных опухолей:
1. метаболический
2. мембранный
3. физико-химический
4. функциональный
5. антигенный
6. морфологический
7. энергетического обмена
8. размножения (бесконтрольное размножение)
9. дифференцировки
10. взаимодействия с организмом хозяина
К биологическим особенностям (атипизмам), характерным только для злокачественных опухолей, относят:
1. инфильтративный (инвазивный) рост
2. метастазирование
3. кахексию
4. рецидивирование
Опухоли могут быть доброкачественными и злокачественными. Злокачественная опухоль – разрастание ткани, обусловленное пролиферацией неопластически трансформированных клеток.
Отличие доброкачественных опухолей от злокачественных
|
№ п/п |
Злокачественные опухоли |
Доброкачественные опухоли |
|
1 |
Быстрый рост. Не отграничены четко, не имеют соединительно-тканной капсулы. На определенной стадии развития характеризуются быстрым увеличением массы |
Сравнительно медленный рост. Хорошо отграничены от окружающей ткани, часто имеют капсулу |
|
2 |
Инфильтративный рост (прорастают в окружающие ткани, разрушая их) |
Экспансивный рост (раздвигают окружа-ющие ткани, но не прорастают в них) |
|
3 |
Имеют тенденцию к метастазированию и отдаленной диссеминации |
Не дают метастазов по следующим причинам: элементы доброкачественной опухоли сцеплены друг с другом значительно прочнее, нежели элементы злокачественного новообразования, отрыву отдельных элементов опухоли и их перемещению в другие органы и ткани в значительной степени препятствует капсула, кровеносные сосуды, проходящие через доброкачественную опухоль, нормальны – опухолевые клетки не составляют их стенок, как это характерно для злокачественной опухоли |
|
4 |
Рецидивируют |
Как правило, не рецидивируют |
|
5 |
Кахексия |
Кахексия бывает редко или слабо выражена, исключение могут составить лишь случаи глубокой деформации массивной доброкачественной опухолью тех или иных отделов желудочно-кишечного тракта |
|
6 |
Иммунодепрессия |
Иммунодепрессия отсутствует |
|
7 |
Клетки не дифференцированы (характерен и клеточный и тканевой атипизм) |
Клетки дифференцированы хорошо (характерен только тканевой атипизм) |
|
8 |
Полиморфизм клеток и ядер |
Отсутствие полиморфизма клеток |
|
9 |
Сосуды сформированы по типу капилляров |
Сосуды сформированы нормально |
|
10 |
Наблюдается извращение обмена веществ |
Обмен веществ такой же, как и в нормальной ткани. |
Этиология и патогенез злокачественных опухолей
Все известные экзогенные канцерогенные факторы делят на 3 основные группы:
1) химические, 2) физические (радиационные, механические), 3) биологические. В соответствии с причинами возникли 3 теории канцерогенеза - химическая, физическая и биологическая, которые взаимодополняют друг друга. Поэтому сейчас говорят о трех группах причин, и теория опухолей называется полиэтиологической (Н.Н.Петров).
Группа химических факторов. Классификация:
1) по исходной канцерогенной активности:
- пре(о)канцерогены (не обладают канцерогенными свойствами, но приобретают их по ходу метаболических превращений в тканях в процессе окисления монооксигеназной ферментной системой, локализованной в эндоплазматической сети гепатоцитов, альвеолоцитов, лейкоцитов и клетках др. органов. Основным действующим началом моноооксигеназной ферментной системы является цитохром Р-450- гемопротеид.
- конечные канцерогены (прямые генотоксические канцерогены) обладают исходными канцерогенными свойствами (эпоксиды, лактоны, хлорэтиламины).
