
- •Этиология и патогенез поврежденИя клетки
- •Этиология и патогенез поврежденИя клетки
- •2. Цели занятия
- •3.Задачи
- •4. Основные учебные вопросы (план)
- •5. Вспомогательные материалы по теме:
- •Сравнительная характеристика некроза и апоптоза
- •Регуляция апоптоза
- •Механизм апоптоза
- •6. Задания для самоподготовки и уирс:
- •7. Литература.
Механизм апоптоза
ФНОα и Fas-лиганд (CD178) запускают каскад биохимических реакций, финальным этапом которых является дефрагментация хромосом и гибель клетки. На поверхности клеток организма имеются специальные рецепторы для ФНОα, это ФНО-RI (с молекулярной массой 55-60 кДа) и ФНО-RII (с молекулярной массой 75-80 кДа), а для Fas-лиганда рецептор Fas/APO-1 (CD95).
ФНО-R и Fas/APO-1(CD95) имеют гомологию в экстрацеллюлярных доменах, представленную в виде цистеин богатых доменов и гомологичную последовательность в интрацеллюлярной части рецептора.
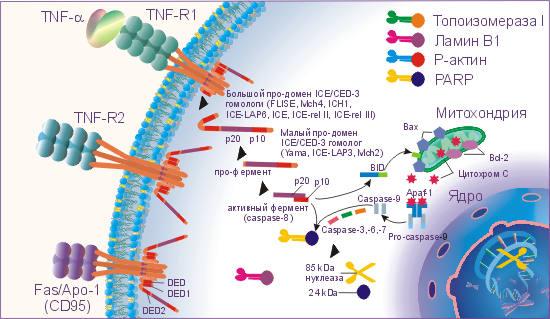
Рис. 2. Механизм апоптоза
Связывание ФНО-α и Fas-лигандов с рецепторами апоптоза активирует интрацеллюлярные "домены смерти" (DED - death effector domain) этих рецепторов: DED, DED1 и DED2 и ряд посредников, включая церамиды, ras, SAPK/JNK, протеиновые тирозинкиназы, катепсин D и протеазы ICE/CED-3 семейства, которые каскадно проводят смертельный сигнал. Цистеиновые протеазы ICE/CED-3 семейства находятся в составе интрацеллюлярной части рецептора апоптоза в неактивной форме, они относятся к интерлейкин-lβ расщепляющим ферментам (ICE). Это семейство включает ряд различных типов протеаз, многие протеазы имеют несколько обозначений. Семейство цистеин-аспартат протеаз ещё называют каспазами.
Как уже говорилось, регулирующую роль в проведении сигнала активации апоптоза по каспазному каскаду выполняет семейство Bcl-2 белков, в котором Bcl-2, Bcl-XL, Ced-9, Bcl-w и Mcl-1 белки ингибируют апоптоз, а Bcl-2 гомологи (BH) 1-3, Bax подобный белок, Bak и Bok, состоящие только из BH3 региона, Bad подобный белок, Bid, Bik, Bim, и Hrk выполняют проапоптозную функцию.
Активация DED, DED1 и DED2 вызывает каскадную перестройку и активацию протеаз ICE/CED-3 семейства. Первым этапом является превращение не активной про-каспазы-8 в активную каспазу-8. Каспаза-8 активирует каспазу-3 и Bid. Bid взаимодействуя с Bax способствует выходу из митохондрий цитохрома C, который активизирует каспазу-9. В свою очередь активная каспаза-9 приводит к появлению активных каспаз-3, -6, -7. В свою очередь активные ICE начинают взаимодействовать с рядом внутриклеточных субстратов: поли-(АДФ-рибозо)полимеразой (PARP), участвующей в репарации ДНК и модификации активности некоторых ядерных белков, ламином В1, топоизомеразой I и Р-актином. Все члены семейства ICE/CED-3 протеаз содержат каталитический остаток цистеина и расщепляют субстраты после аспарагиновой кислоты. Специфическое расщепление PARP, ламина В1, топоизомеразы I и Р-актина под действием ICE-подобных протеаз на большие и малые фрагменты приводит клетку к гибели, так как большие фрагменты этих субстратов и являются активными нуклеазами, которые разрезают хромосомы на фрагменты. Например, PARP расщепляется CPP32/Yama на два фрагмента 85 и 24 кДа, из которых апоптоз-специфическим является фрагмент 85 кДа. Активация протеаз ICE/CED-3 семейства может происходить и под действием фосфолипидов, например, церамидов, которые способны активировать CPP32/Yama.
Свободный сфингозин образуемый из церамидов в результате его гидролиза церамидазой так же активирует ICE-подобные протеазы и ускоряет апоптоз.
Важная роль в осуществлении апоптоза принадлежит тироксину (Т4).

Рис. 3. Тироксин
Он регулирует функционирование протеиновой тирозинкиназы, важного элемента реализации сигнала смерти. При недостатке этого гормона щитовидной железы происходит подавление апоптоза.
IL-lβ блокирует апоптоз. ICE-подобные протеазы взаимодействуют с IL-lβ, а не с PARP, ламином В1, топоизомеразой I и Р-актином. В результате чего не происходит образования активных нуклеаз, и клетка избегает апоптоза.
На взаимодействие ФНОα и Fas-лигандов с ФНО-R и Fas/APO-1(CD95) и проведение апоптотического сигнала оказывают влияние Bcl и Bax белки. Так белки Bcl семейства: Bcl-2, Bcl-xL и Bcl-xS блокируют выход цитохрома С из митохондрий и таким образом предотвращают превращение про-каспазы-9 в активную форму, отменяют атоптотический сигнал. В свою очередь Bax белки способствуют выходу цитохрома С из митохондрий и образованию активной каспазы-9, которая инициирует продолжение и активацию апоптотическог каскада, начавшегося с присоединения ФНОα или Fas-лигандов к ФНО-R и Fas/APO-1(CD95). Быть или не быть апоптозу зависит от соотношения Bcl и Bax белков в митохондриях. Преобладание экспрессии белков Bcl семейства блокирует запуск апоптоза, а преобладание экспрессии Bax белков способствует реализации сигнала смерти.
ПРАКТИЧЕСКАЯ ЧАСТЬ ЗАНЯТИЯ
Реакция непрямой дегрануляции тучных клеток
1. Экспериментальная часть.
2. Самостоятельная работа.
Экспериментальная часть
Реакция непрямой дегрануляции тучных клеток рассматривается как пример повреждения клетки при аллергическом процессе.
Реакция непрямой дегрануляциитучных клеток
(в модификации Л.М.Ишимовой и Л.И.Зеличенко)
Постановка теста предусматривает использование следующих
ингредиентов:
1. Сыворотки крови обследуемого больного.
2. Перитонеальных тучных клеток крысы.
3. Специфического (опытного) аллергена растительного или пищевого происхождения, рассматриваемого как фактор сенсибилизации.
4. Заведомо неспецифического (контрольного) аллергена.
Кровь для исследования от больного обычно получают путем протокола кожи пальца или берут из вены, в количестве, необходимом для исследования. На каждый опытных препарат требуется 0,05 мл сыворотки и столько же сыворотки для контроля. Сыворотку получают путем центрифугирования крови в течение 20-30 мин. при 1500 об/мин. В реакции можно использовать как свежую сыворотку, так и сыворотку, сохраняемую при температуре - 200С. Специальные эксперименты показали, что непрямая дегрануляция тучных клеток не происходит в бескомплементарной среде. Так, если в инактированной нагреванием сыворотке без комплемента число дегранулированных клеток не превышало 2% (Л.И.Зеличенко,1969 г.), то при использовании той же сыворотки, но не подвергшейся инактивации, частота дегрануляции достигла 60%. При добавлении к перитонеальным клеткам крысы инактивированной сыворотки, специфического аллергена и комплемента человека реакция полностью восстанавливалась.
При получении перитонеальных тучных клеток крысы (лучше использовать самцов весом 140-200 гр.) животных забивают путем кровопускания из сонной артерии или декапитации, после чего им вводят внутрибрюшинно 6-8 мл. подогретого (37ºС) раствора Тироде без глюкозы или раствора "Хемоцелл" (ГДР). В продолжение 1-11/2минут производят легкий массаж передней стенки живота и затем по его средней линии делают ножницами послойный разрез длиной 1,5-2 см. Осторожно переворачивают тушку разрезом вниз с тем, чтобы из нее свисали петли кишечника. Подставляют к петлям пробирку, смоченную гепарином. При этом с петель кишечника в пробирку начинает стекать перитонеальная взвесь. Для получения антикоагулирующего эффекта ее осторожно перемешивают и в продолжение всего исследования хранят при 370С.
С целью отделения тучных клеток от остальных клеточных элементов перитонеальной взвеси применяют метод дифференциального центрифугирования в градиенте плотности сахарозы. Сахароза может быть заменена полисахаридом - фиколлом, концентрированным раствором альбумина или другими высокомолекулярными соединениями. Особенность таких растворов состоит в том, что они не стимулируют спонтанную дегрануляцию тучных клеток. Для проверки этого клетки перед каждым новым исследованием просматривают под микроскопом. При обнаружении дегрануляции взвесь тучных клеток бракуют.
При постановке теста используют предметные стекла, предварительно окрашенные 0,3% раствором нейтрального красного, приготовленным на абсолютном спирте. На предметное стекло наносят 0,05 мл исследуемой сыворотки крови 0,05 мл перитонеальной взвеси, полученной от крысы, и 0,05 мл опытного или контрольного аллергена. Смесь накрывают покровным стеклом, края которого промазаны вазелином. Препараты на 10-15 мин помещают в термостат при 370С и затем микроскопируют. Каждому опыту сопутствуют три контроля: 1)взвесь тучных клеток и аллерген; 2)взвесь тучных клеток и исследуемая сыворотка; 3)взвесь тучных клеток, исследуемая сыворотка и неспецифический аллерген, например, один из пищевых аллергенов. Допустимая дегрануляция в контролях не более 10% от числа отсчитанных клеток.
Оценка теста производится путем микроскопии препарата (Х280), в котором просматривается 100 тучных клеток, не соприкасающихся друг с другом. Клетки делятся на 2 категории: нормальные и дегранулированные. Нормальные клетки обычно имеют округлую форму, реже - удлиненную или веретенообразную. Их протоплазма компактно заполнена гранулами малинового цвета. Ядро клетки светлое. Иногда на него накладываются окрашенные гранулы.
Дегрануляция тучных клеток выражается в ослаблении окраски гранул,в цитоплазме обнаруживаются вакуоли. Края клетки могут становиться разбухшими, неровными, с бесцветной "кроной", разрывом и "выходом" гранул. Клетки, потерявшие окраску полностью, имеют вид "медовых сот". Тест считается отрицательным, если число дегранулированных клеток не превышает 10%. Процент дегранулированных тучных клеток определяется путем вычивания наибольшего числа дегранулированных клеток в одном из контролей из результатов подсчета клеток в опытном препарате. Так, если число дегранулированных клеток в опытном препарате составляет 16%, а в одном из контролей доходит до 8%, то конечный результат будет составлять 8%. В этом случае тест учитывается как отрицательный. При резко положительной реакции окончательный результат может превышать 30%. Условно выделяют 3 степени положительной реакции: 1)слабоположительную (+) - от 10 до 29% дегранулированных клеток; 2)положительную (++) - от 20 до 29%; 3) резко положительную (+++) - от 30% и более.
Самостоятельная работа
а) микроскопия препарата;
б) вычисление процента дегранулированных клеток;
в) оуенка результатов исследования и выводы;
г) оформление протокола исследования.
