
- •Лекция 16
- •ПЛАН
- •Коллоидная химия – это
- •Дисперсными называют- ся микрогетерогенные системы, в которых микроскопические час- тицы дисперсной фазы равномерно
- •Модель дисперсной системы
- •Классификация дисперсных систем
- •2) По степени взаимодействия дисперсной фазы и дисперсионной среды
- •а)Системы, в которых сильно выражен эффект сольватации называются лиофильными (растворы ВМС и ПАВ).
- •б) Системы, в которых эффект сольватации отсутствуют, называются лиофобными (дисперсии металлов и трудно-
- •3) По отсутствию или наличию межмолекулярного взаимодействия между частицами дисперсной фазы
- •б) связнодисперсные
- •4) По агрегатному состоянию дисперсной фазы и дисперсионной среды
- •Соли-
- •Согласно современным представлениям, любое твердое тело – это высо- кодисперсная система, так как
- •16.2 Для получения коллоидных растворов (золей) используют:
- •Метод диспергирования– дробление крупных частиц до кол- лоидной степени дисперсности.
- •Диспергирование можно осу- ществлять различными путями: а) механическое дробление (шаровые, коллоидные мель- ницы);
- •г) метод пептизации,
- •Различают адсорбционную и химическую пептизацию. При адсорбционной пептизации ионы электролита-пептизатора адсорбируются на поверхности
- •При химической пеп- тизации электролит- пептизатор образуется в результате хими- ческой реакции, проте-
- •Пептизация имеет большое биологическое значение:
- •Метод конденсации
- •Конденсация
- •В основе химической конденсации лежат химические реакции, протекающие с образова- нием труднорастворимых соединений.
- •• гидролиз
- •Получение дисперсных систем методом физической кон- денсации выполняют:
- •• понижением темпера-
- •В условиях организма превалирующим является конденсационный метод. Одним из немногих примеров образования дисперсных
- •Методы очистки золей
- •Диализ основан на применении мембран, задерживающих крупные коллоидные частицы и пропускающих ионы и
- •Простейший диализатор
- •Диализ протекает медленно, но он может быть ускорен путем пропускания электри- ческого тока
- •Такой процесс получил название электродиализа, а соответствующий прибор – электродиализатора.
- •Ультрафильтрация
- •Фильтрование обычно прово- дят под давле- нием или в вакууме.
- •Применяя мембраны с определенной степенью пористости, можно не только разделять кол- лоидные частицы,
- •Этим методом впервые были опре- делены размеры целого ряда вирусов и бактериофагов.
- •Процесс ультрафильтрации лежит в основе функции почек. Вещества с молярной массой до 10
- •Примером сочетания диа- лиза и ультрафильтра- ции является аппарат "искусственная почка", предназначенный для
- •Аппарат подключают к системе кровообращения больного. Кровь под давлением, создаваемым пульсирующим насосом ("искусственное
- •Прибор «Искусственная почка»
- •16.3 Согласно мицеллярной тео- рии, золь состоит из мицелл и интер- мицеллярной жид-
- •Мицелла – это электро- нейтральная частица дис- персной фазы, окруженная двойным электрическим слоем
- •Основу мицеллы составляют микрокристаллы трудно- растворимого вещества, называемые агрегатом. В результате избирательной адсорбции
- •Пример 1. Рассмотрим строение мицеллы золя
- •Электролит в избытке (AgNO3) является
- •Формула мицеллы AgI
- •ПОИ – потенциалопредляющие ионы, адсорбирующиеся на поверхности агрегата,
- •Коллоидная частица (гранула) – это часть мицеллы, состоящая из агрегата и адсорбционного слоя.
- •Пример 2. Рассмотрим строение мицеллы золя
- •В данном случае электро- литом-стабилизатором явля-
- •Фомула мицеллы AgI
- •Заряд коллоидной частицы равен:
- •Образование двойного элект- рического слоя (ДЭС) приводит к тому, что на поверхности раздела
- •ξ– потенциал служит
- •16.4 Физические свойства растворов
- •Важнейшие молекулярно- кинетические свойства
- •2) Диффузия – самопроизвольный процесс выравнивания концентраций частиц по всему объему раствора в
- •Седиментация – процесс оседания частиц дисперсной фазы под действием силы тяжести. В золях
- •Седиментационное равновесие характеризуется постепенным увеличением концентрации дисперсной фазы от верхних слоев к нижним:
- •Определение скорости оседания положено в основу седиментационного анализа. Он широко используется для качественной
- •Особые оптические свойства дисперсных систем обус- ловлены тем, что размеры коллоидных частиц сопоставимы
- •Если луч света направить на коллоидный раствор сбоку, то его путь будет обнаруживаться
- •Конус Тиндаля
- •Основанные на эффекте Тиндаля методы определения размера и концентрации коллоидных частиц (ультра- микроскопия
- •Короткие волны (синяя и фиолетовая часть спектра) рассеиваются сильнее, чем длинные (желто-красная часть
- •Этим объясняется голубой цвет неба.
- •Электрокинетическими явлениями называются процессы, протекающие в золях под воздействием внешнего электрического поля.
- •К важнейшим электро- кинетическим явле- ниям относятся:
- •Электрофорез (электро... и греч. phoresis - несение)-это направ- ленное движение коллоидных частиц или
- •Скорость движения частиц к электродам (u) связана с напря- жённостью электрического поля (Е)
- •Электрофорез широко применяется в медицине и
- •Этот метод применяется в медицине для диагностики и контроля за ходом болезни, т.к.
- •Введение лекарственных веществ методом электрофореза имеет ряд преимуществ по сравнению с обычными способами
- ••образование «кожного депо»
- ••не раздражается слизистая
- •Благодаря этим преимущест- вам лекарственный электро- форез находит все большее применение, в том
- •Электроосмос –
- •В медицине электроосмос при- меняется для очистки лечебных сывороток.
- •16.5 Под устойчи- востью дисперсной системы понимают постоянство во вре- мени ее состояния
- •Различают два вида устойчивости золей:
- •Причиной кинетической устойчивости является броуновское движение, которое противодейст- вует оседанию частиц под действием
- •Агрегативная устойчи- вость золей обусловлена наличием ДЭС у коллоидных частиц, что препятствуют их
- •Другими словами, наличие одноименных зарядов у коллоидных частиц приводит к их отталкиванию друг
- •При нарушении агрегативной устойчивости золей происходит их коагуляция.
- •Коагуляция - процесс объединения коллоид- ных частиц в более крупные агрегаты вследствие полной
- •Коагуляция-
- •Коагуляцию может вызывать:
- •Наибольшее практи- ческое значение имеет коагуляция золей электроли- тами.
- •Все сильные электроли- ты вызывают коагуля- цию золей при увеличении их концент- рации
- •Порог коагуляции (γ) –
- •Коагулирующие действие электролитов описывается правилом Шульце – Гарди: коагуляцию вызывают ионы с зарядом,
- •Дерягин и Ландау показали, что
- •Правило Шульце - Гарди носит приблизительный характер,
- •Ионы с одинаковыми зарядами, но различными ионными радиусами, образуют лиотропные ряды:
- •Коагулирующие действие электролитов связано с уменьшением заряда коллоидных частиц за счет сжатия диффузного
- •Сжатие диффузного слоя можно представить схемой:
- •Процесс коагуляции золя характеризуется определенной величиной скорости коагуля- ции, которую можно опре- делить
- •Скорость коагуляции золя электролитами зависит как от концентрации самого золя, так и от
- •Кинетическая кривая коагуляции
- •Отрезок ОА отвечает периоду скрытой коагуляции, при которой золь сохраняет свою устойчивость.
- •В точке А начинается явная коагуляция, которая соответствует уменьшению ξ-потен- циала коллоидных частиц
- •На участке БВ скорость коагуляции остается постоянной; это связано с тем, что при
- •При этом скорость коагуляции достигает максимального значе- ния; этот отрезок кинетической кривой соответствует
- •При коагуляции золя смесью электролитов можно наблюдать: а) явление аддитивности - суммирование коагулирующего
- •в) явление синергизма - усиление коагу- лирующего действия одного иона в присутствии другого.
- •При введении лекарственной смеси солей следует убедится, что эти они не являются синергистами,
- •Коагуляции играет существенную роль в живом организме, т.к. коллоидные растворы клеток находятся в
- •При введении в
- •Так, физиологический раствор NaCl нельзя заменить изотоничным раствором MgCl2, пос-
- •Решение многих проб- лем в медицине (протезирование крове- носных сосудов, клапа- нов сердца
- •Во время операции в кровь вводят анти- коагулянт - гепарин, а после для
- •Коагуляция также происходит при смеше- нии двух золей с различными знаками заряда их
- •Такой тип коагуляции применяется в сани- тарно-гигиенической практике при очистке воды от взвешенных
- •Благодарим

Лекция 16
Коллоидная
химия

ПЛАН
16.1Дисперсные системы и их классификация.
16.2Получение и очистка коллоидных растворов.
16.3Строение мицелл лио- фобных золей.
16.4Физические свойства золей.
16.5Устойчивость коллоидных растворов. Коагуляция.

Коллоидная химия – это
химия дисперс- ных систем.

Дисперсными называют- ся микрогетерогенные системы, в которых микроскопические час- тицы дисперсной фазы равномерно распределены в дисперсионной среде.
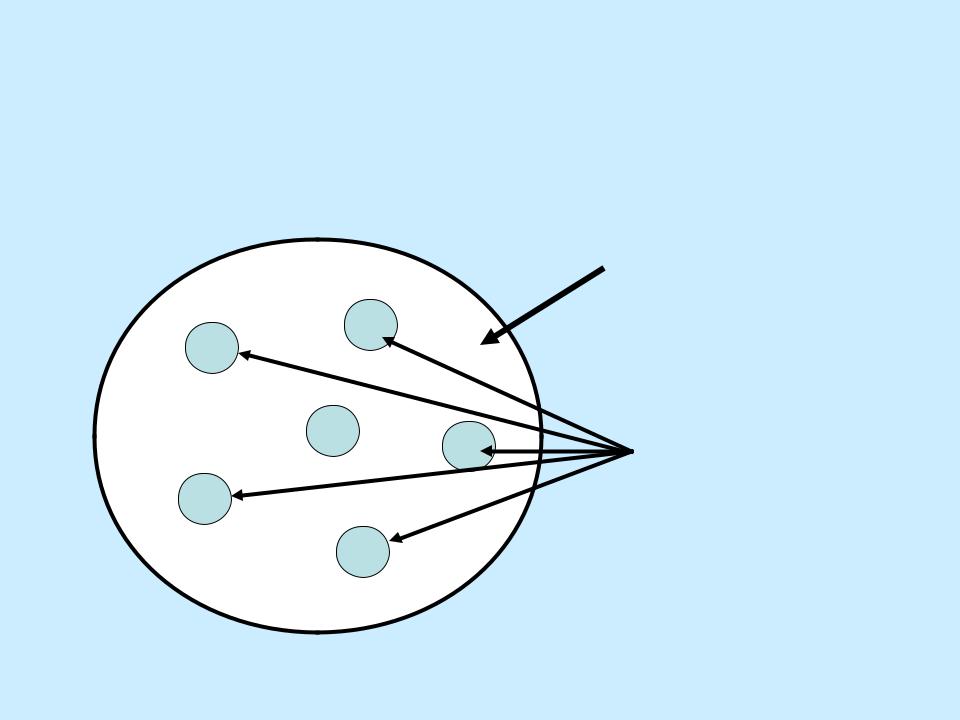
Модель дисперсной системы
Дисперсионная
среда
Частицы
дисперсной фазы
Классификация дисперсных систем
1) По величине частиц дисперсной фазы
Коллоидно- |
Грубо- |
дисперсные |
дисперсные |
10‾9< α< |
10‾7< α < 10‾5м |
10‾7м |
|

2) По степени взаимодействия дисперсной фазы и дисперсионной среды
Под их взаимодействи- ем понимают образова- ние сольватных оболо- чек вокруг частиц дисперсной фазы

а)Системы, в которых сильно выражен эффект сольватации называются лиофильными (растворы ВМС и ПАВ). Они устойчивы; их образо- вание протекает само- произвольно.

б) Системы, в которых эффект сольватации отсутствуют, называются лиофобными (дисперсии металлов и трудно- растворимых солей). Они не устойчивы; их образование протекает не самопроиз- вольно.

3) По отсутствию или наличию межмолекулярного взаимодействия между частицами дисперсной фазы
а) свободнодисперсионные – частицы не связаны между собой и свободно пере- мещаются (аэрозоли, лио- золи)
