
экзамен / Вопросы к экзамену
.docxОтветы на вопросы по термодинамике.
-
Термодинамическая система. Взаимодействие системы с окружающей средой. Открытая, закрытая, изолированная, термодеформационная системы.
Термодинамическая система- тело, совокупность тел, часть тела подлежащее исследованию. Все остальные тела называются окружающей средой.
Взаимодействие системы с окружающей средой заключается в обмене веществом и энергией.
Система, которая может обмениваться с окружающей средой энергии и веществом называется открытой. Система, которая не может обмениваться веществом называется закрытой.
Система, которая не может обмениваться не энергией, не веществом – изолированная.
Система, в которой теплообмен представлен в виде Q и Aмех, связанной с упругой деформацией растяжения/сжатия, называется термодеформационной.
-
Экстенсивные и интенсивные параметры состояния. Уравнения состояния для идеального и реального газов (уравнение Клапейрона- Менделеева и уравнение Ван-дер-Ваальса).
Начну с того, что любое энергетическое влияние характеризуется двумя параметрами:
-
интенсивные- параметры, которые не зависят от количества вещества, а следовательно и от массы системы. Например, температура, давление. все удельные величины.
-
Экстенсивные- параметры, зависящие от количества вещества, в следствии чего и от массы системы. Например, объем системы, ее масса.
Клапейрона- Менделеева

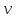 – удельный
объем,
– удельный
объем,
 -универсальная газовая постоянная.
-универсальная газовая постоянная.
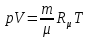
Уравнение Ван-дер-Ваальса
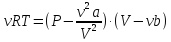
-
Зависимость количества передаваемой теплоты, работы закрытой и открытой систем от параметров состояния. Изображение работы и теплоты в p-v и T-s диаграммах.
-
Понятие истинной и средней теплоемкостей. Уравнение Майнера. Расчет теплоемкостей
 идеального газа. Зависимость теплоемкости
от показателя политропы (формула и
график)
идеального газа. Зависимость теплоемкости
от показателя политропы (формула и
график) -
Внутренняя энергия, энтальпия. Физический смысл. Расчет изменение внутренней энергии и энтальпии идеального газа.
-
Первый закон термодинамики (первое и второе уравнения). Физический смысл, различные формы записи.
Если отталкиваться от лекций, то первый закон ТД заключается в том, что процессы в термодинамической системе могут возникать тогда и только тогда, когда на систему оказывается внешнее энергетическое воздействие. А полученное тепло системой идет на совершение работы и увеличение внутренней энергии.


в учебнике по теории смысл такой же, а вот формулы другие:
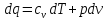
В интегральной форме:
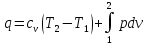
-
Термодинамический процесс. Равновесность. Обратимость. Политропный процесс. Вывод уравнения политропного процесса.
-
Расчет термодинамических величин (работы закрытой и открытой системы, количества теплоты, изменение внутренней энергии и энтальпии).
-
Расчет энтропии и ее изменения в политропном процессе.
-
Частные процессы идеального газа. Изображение на диаграммах состояния.
-
Частные процессы идеального газа. Расчет термодинамических величин (работы закрытой и открытой системы, количества теплоты , изменения внутренней энергии и энтальпии)
-
Анализ политропного процесса по диаграммам состояния.
-
Определение показателя политропы. Расчет произвольного процесса идеального газа.
-
Прямые и обратные циклы. Определение эффективности циклов (коэффициент полезного действия, холодильный коэффициент, отопительный коэффициент). Циклы как метод термодинамического аналог.
-
Прямой цикл Карно. Основные выводы, получаемые при анализе цикла Карно.
-
Второй закон термодинамики. Физический смысл, математическое выражение. Примеры (неравновесный теплообмен). Статический смысл.
-
Характеристические функции. Аналитические выражения, области применения.
-
Эксергия. Физический смысл. Вывод уравнения для расчета эксергии и ее изменения в термодинамическом процессе.
-
Реальный газ. Фазовые превращения первого и второго рода.
Реальный газ
Отличия реального газа от идеального, заключаются в наличии сил взаимодействия между молекулами и в учёте собственного объема молекул,
которые для идеальных газов не учитывались. Это выражается, прежде всего, в наличии потенциальной части внутренней энергии, в изменении уравнения
состояния, в зависимости теплоёмкости от температуры и давления и в
переходе реальных газов при определённых термодинамических параметрах в жидкое и твёрдое состояние.
Фазовые превращения первого и второго рода.
Фаза – гомогенная однородная область в гетерогенной среде на границе которой имеет некоторые свойства вещества претерпевают скачкообразное изменение.
Фазовые превращения первого рода

Их можно охарактеризовать неравенством первой производной энергии Гиббса:
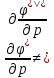
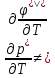

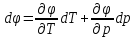
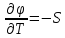
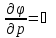
Так же эти переходы характеризуются

Характеризуются поглощением или выделением Q.
Фазовые переходы второго рода

Такие переходы тоже можно охарактеризовать производными энергии Гиббса.
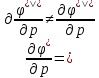
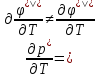
20. Реальный газ. Диаграммы состояния p-T, p-v, T-s, i-s. Критическая точка. Тройная точка. Пограничные кривые. Изображение частных процессов на диаграммах состояния.
Реальный газ
Отличия реального газа от идеального, заключаются в наличии сил взаимодействия между молекулами и в учёте собственного объема молекул,
которые для идеальных газов не учитывались. Это выражается, прежде всего, в наличии потенциальной части внутренней энергии, в изменении уравнения
состояния, в зависимости теплоёмкости от температуры и давления и в
переходе реальных газов при определённых термодинамических параметрах в жидкое и твёрдое состояние.
Критическая точка

Диаграммы
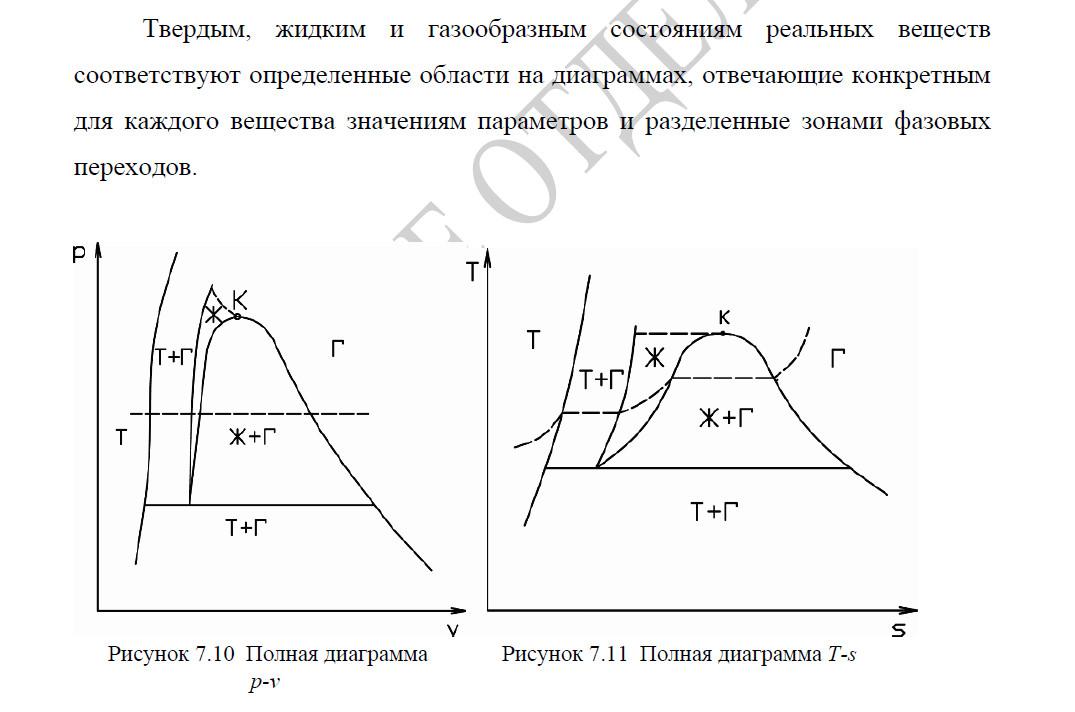
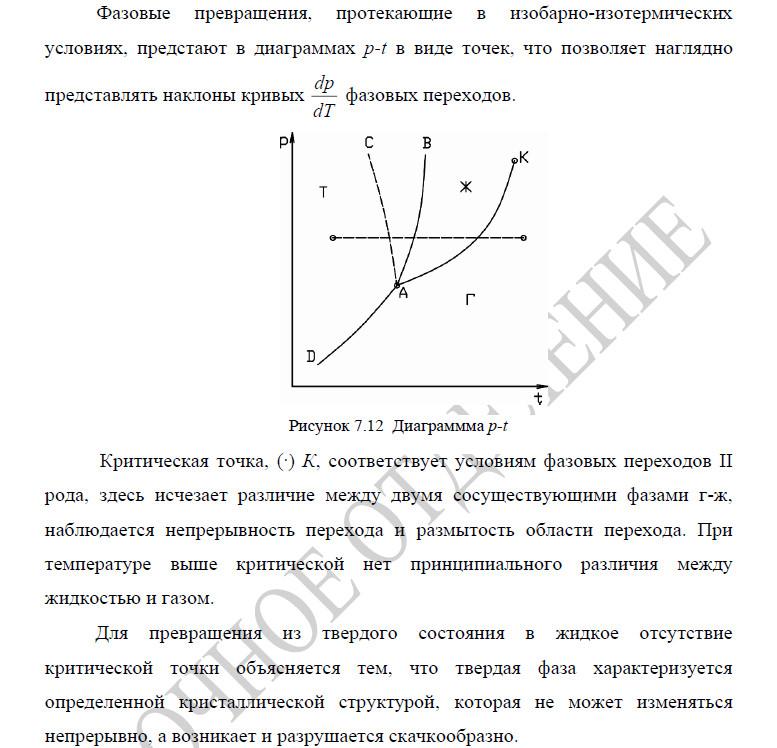


21. Определение параметров состояния реального газа на пограничных кривых. Определения параметров состояния влажного и перегретого паров.
22. Вывод уравнений для расчёта теплоты парообразования. Зависимость теплоты парообразования от температуры и давления. Изображение в T-s координатах.
23. Уравнение Клаперона- Клаузиуса. Вывод уравнения, физический смысл. Интегральные формы уравнения. Связь уравнения с диаграммой состояния р-Т.
24. Реальные газы. Расчет частных процессов и их изображение на диаграммах состояния p-v , T-s, i-s.
25. Течение газов через конфузор. Предельная скорость течения. Учет трения.
26.
Получение сверхзвуковых скоростей.
Сопло Левеля.
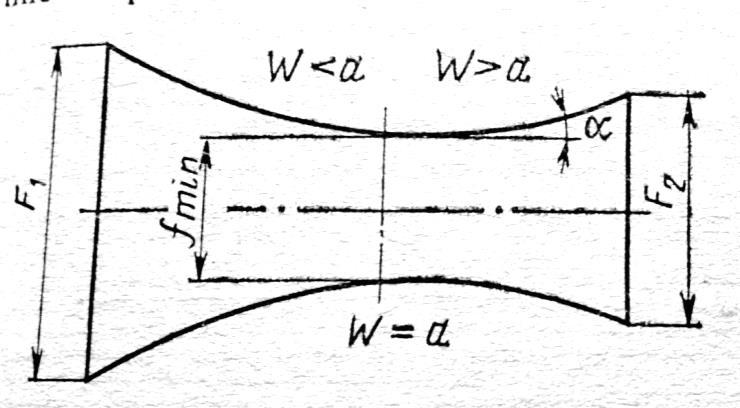
Скорость газа большую скорости звука можно получить в комбинированном сопле, состоящем из суживающейся расширяющейся части. Это сопло имеет название Лаваля.(Левеля (честно все равно)).
Сужающая
часть работает при до звуковой скорости
(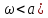 ,
расширяющаяся – при сверхзвуковой (
,
расширяющаяся – при сверхзвуковой ( .
В меньшем сечении сопла скорость потока
равна местной скорости звука.
.
В меньшем сечении сопла скорость потока
равна местной скорости звука.
Это показывает уравнение (смотрите я делаю два варианта, выберите сами) :
Вариант 1


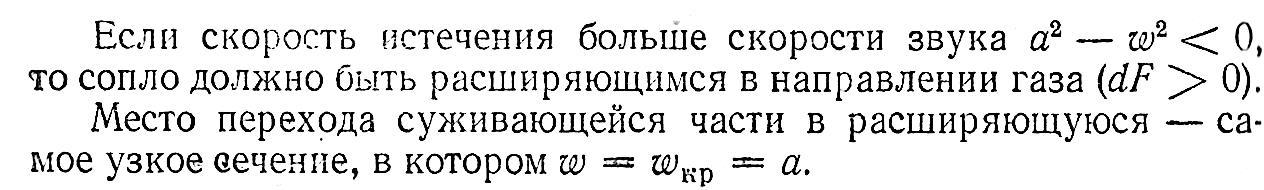


Вариант 2

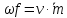
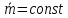
 разделим
на
разделим
на
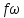
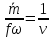
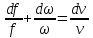
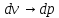

1.
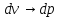

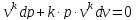

(2)
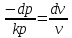
2.
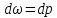
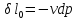
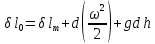 ,
где
,
где

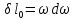
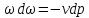 ,
,

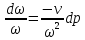
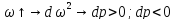
Соединим все уравнения:
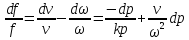
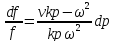
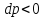
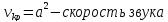
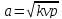
1. Если увеличивающаяся скорость потока меньше скорость звука, то
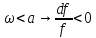
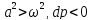
2.


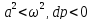
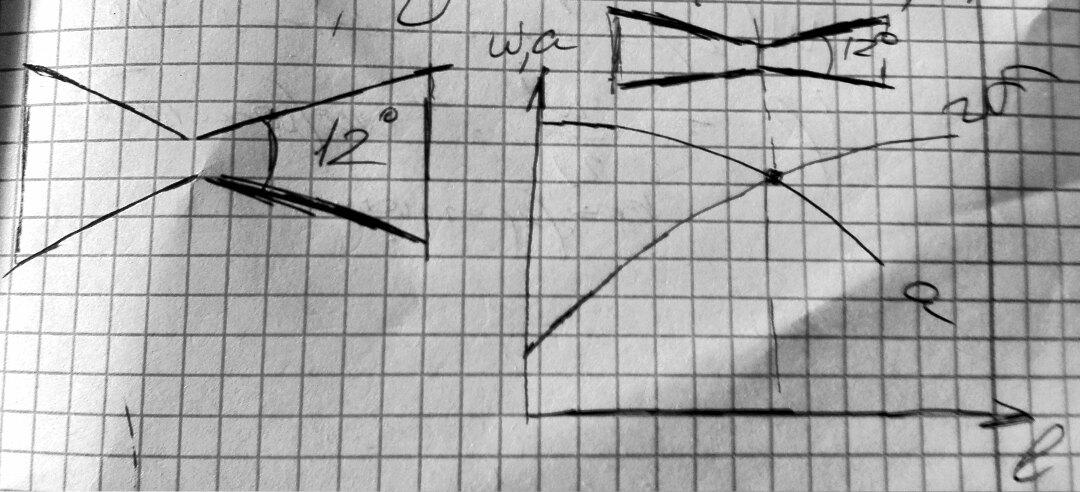
27. Дросселированние. Дроссель эффект.
Дросселирование – понижение давления потока при прохождении через резкое сужение.
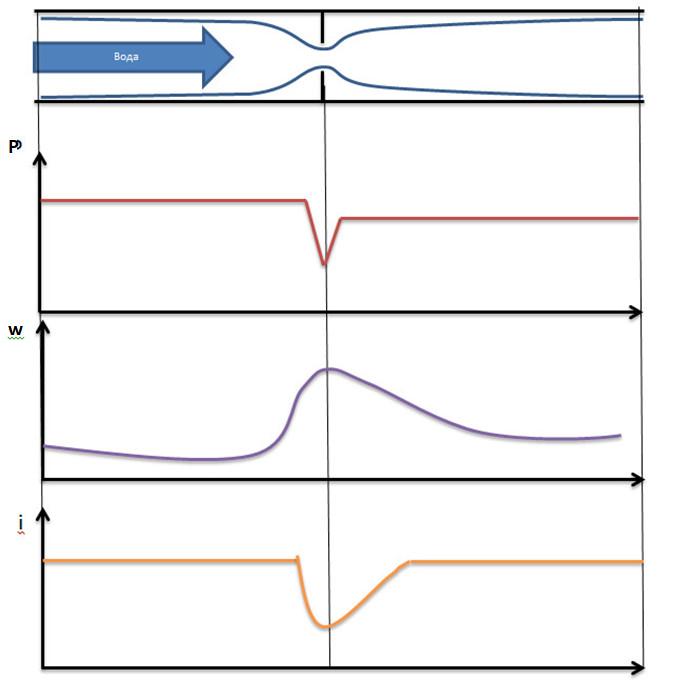
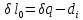
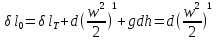
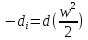

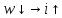
Температурный эффект Джоуля Томпсона.
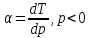
1)

2)
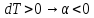
3)

Геометрические места точек, где дроссель эффект равен 0, называется кривой инверсии.

Для идеального газа дроссель эффект равен =0
Это из методы.

28. Струйные аппараты. Принцип работы. Схема аппарата. Коэффициент инжекции. Изображение в i-s координатах.
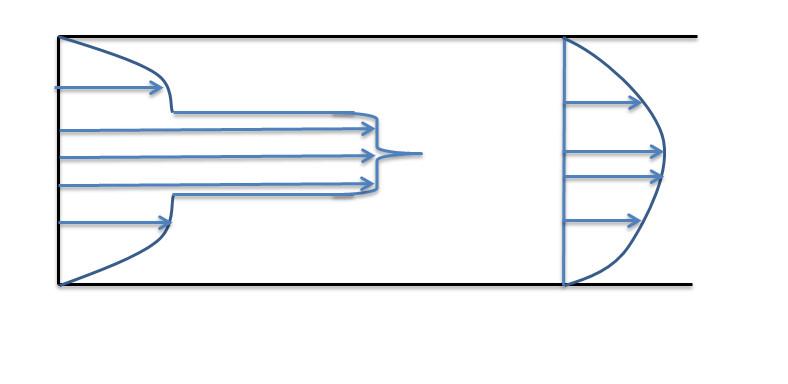
Струйные аппараты - где происходит смешение и обмен энергии двух потоков и имеющих разные давление.
При прохождении сопла скорость потока увеличивается, давление уменьшается. Поток имеющий более высокое давление рабочий поток. Поток имеющий более низкое давление инжектированный.
Такой аппарат используется для увеличения температуры пара, для удаления воздуха из аппарата создание и поддержание вакуума, подачи воды с колодцев и т.д
Струйные аппараты более надежды по сравнению с механическими нагнетательными аппаратами, но менее экономичны.
Потоки пар,газы,жидкости,
смеси..
пар,газы,жидкости,
смеси..
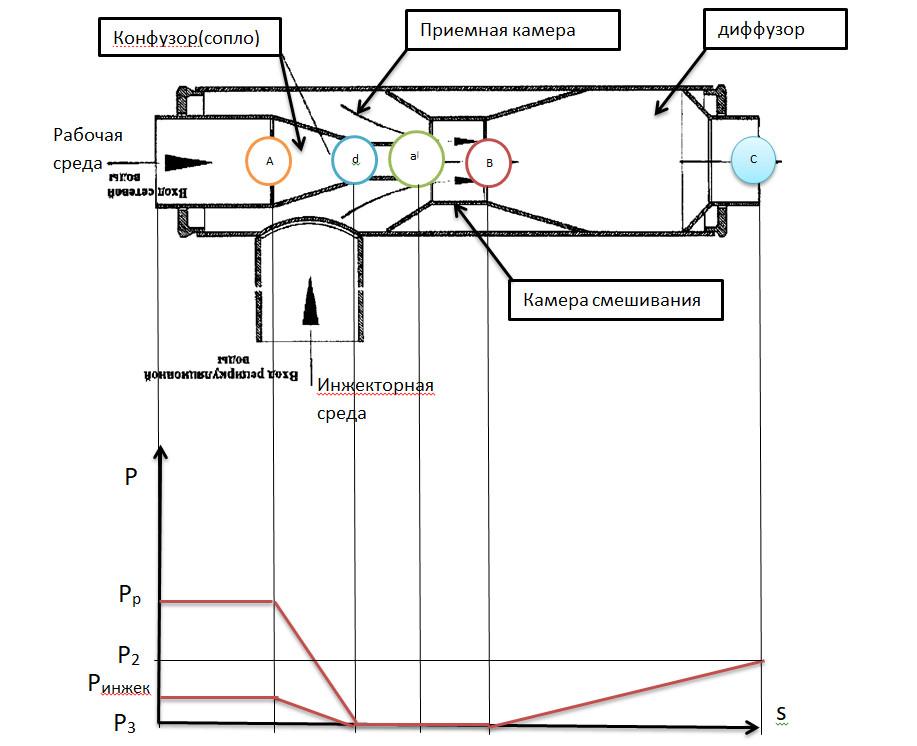
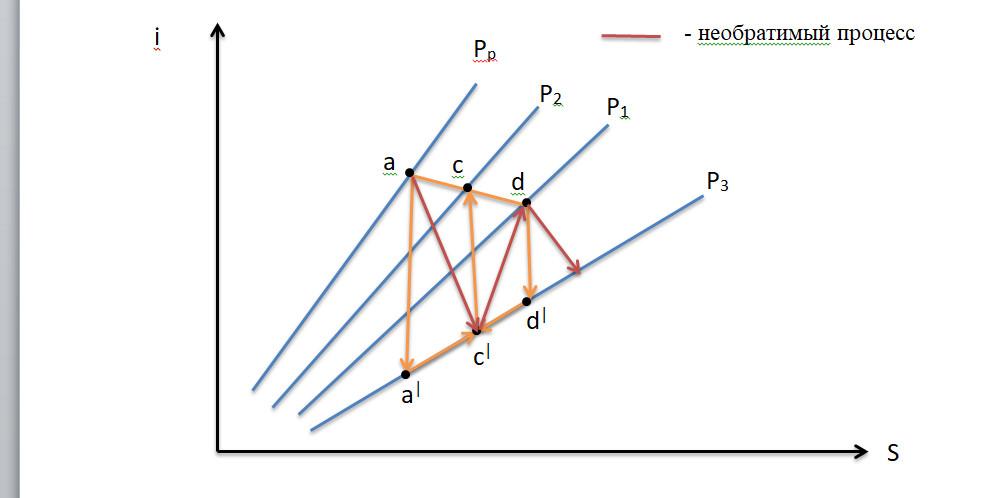
aa|- расширение рабочей среды при прохождении сопла
dd|- расширение инжекторной среды
aвd|- смешение потока
aа|a –повышения давления потока в диффузоре
Коэффициент инжекции рассчитывается :

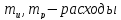
29. Цикл идеального компрессора одноступенчатого и многоступенчатого. Расчет мощности и отводимой теплоты. Изображение в p-v и T-s диаграммах.
30. Особенности реального компрессора и их учет.
31. Методы получения низких температур. основные параметры характеризующие работу холодильной установки. Обратный цикл Карно.
32. Воздушная холодильная установка. Схема установки. Расчет основных характеристик. Изображение в T-s и p-i диаграммах.
33. Парокомпрессионная холодильная установка. Схема установки. Расчет основных характеристик. Изображение в p-v и T-s диаграммах.
34. Парокомпрессионная холодильная установка. Схема установки. Виды циклов и их изображение в T-s диаграмме. Требование к хладагентам.
35. Парокомпрессионная холодильная установка. Схема установки. Изображение холодопроизводительности и затраченной работы в p-v и T-s диаграммах. Влияние температуры испарения и температуры конденсации на температурный коэффициент.
36. Абсорбционная холодильная установка. Схема установки. Принцип работы. Коэффициент использования теплоты.
37. пароэжекторная холодильная установка. Схема установки. Изображения в Т-s диаграмме.
38. Термотрансформаторы. Принцип работы. Коэффициент преобразования теплоты.
39. Промышленное производство энергии. Цикл Райкина. Схема установки. Расчёт основных характеристик. Изображение в T-s координатах. Влияние температуры и температуры конденсации на КПД.
Промышленное производство энергии

Цикл Райкина

Схема установки.
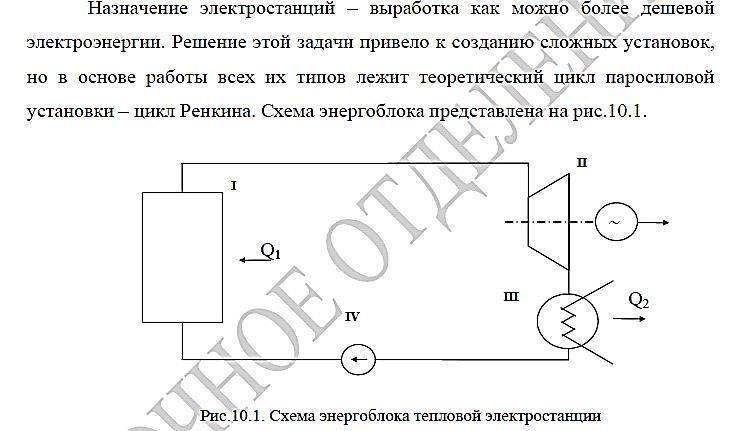
Пояснение к схеме:

Изображение в T-s координатах
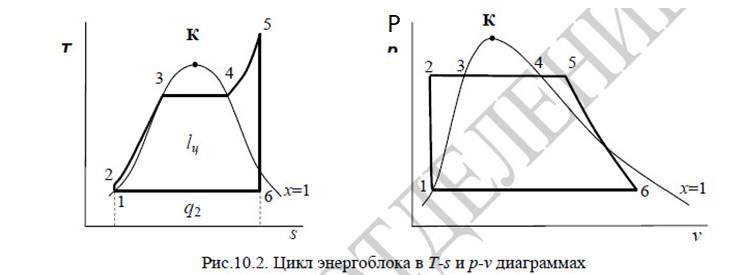


*из лекций
2-5 – на этом участке мы подводим теплоту, p=const , q1=i5-i2
5-6 S=0, q=0 , lп=i5-i6
Расчёт основных характеристик.






-
из лекций
КПД прямого цикла
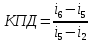
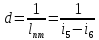
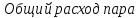
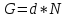
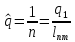
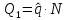
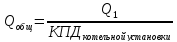
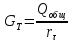
40. Влажный воздух. Кондиционирование воздуха в зимнее и летнее время.
41. Влажный воздух. Конвективная сушка. Тепловой кпд сушилки.
42. Циклы тепловых двигателей. Основные допущения, используемые при анализе циклов. невозможность реализации цикла с высоким КПД. Сравнения циклов Отто и Дизеля.
43. Циклы газовой турбины. Схема установки. КПД цикла. Сравнение с циклами Отто и Дизеля.
44. Первичные источники энергии. Их характеристики. Основные энергоемкие процессы.
45. Вторичные энергоресурсы. Классификация. Повышение потенциала ВЭР. Примеры использования (многокорпусное выпаривание…и что-то еще)
Классификация.
По виду
-
Тепловая (энергия потоков)
-
Горючие вещества
-
Потоки имеющие высокое давление
По схеме использования
1) Внутренние – ресурсы используются в одной и той же установке
2) Разомкнутая
3) Комбинированная
Повышение потенциала ВЭР
1) с помощью смешения с высококачественным топливом
2) Сжатие водяного пара
Примеры:
1. Подогрев материала потоков при подходе к установке
2. Процесс получение кокса. (используется вторичный газ вместо воды)
3. Примеры выпаривания
процесс увеличения концентрации растворов не летучих веществ, удалние испарения при кипении.
