
экзамен / TEHNIChESKAYa_TERMODINAMIKA
.pdfвещества в системе (например, объем V , внутренняя энергия U, теплота Q, работа А и т.п.), отнесенные к количеству вещества в системе представляют удельные параметры и величины, являющиеся более универсальными, чем полные, поскольку предоставляют возможности сравнивать системы и эффекты процессов в них. Удельные параметры и величины обозначают малыми буквами: v, u, q, a и т.п.
Записанные через удельные величины, уравнения состояния и процессов могут быть применимы как для описания закрытых, так и открытых систем. Состояния и процессы могут изображаться на плоскости в виде точек и линий процессов в системах координат из двух параметров, которые называют
диаграммами состояния.
Уравнение первого закона термодинамики для термомеханической системы, записанное в удельных величинах предстает в виде:
δq = du + δl (1.9)
Разнообразие видов механических воздействий отражается в выражениях этих работ через интенсивные и экстенсивные параметры, то есть через потенциалы и координаты.
1. Работа по перемещению тела или удлинению тела под действием силы F (одномерная задача):
δА = F dx
где δА – элементарная работа (Дж), F - сила, действующая со стороны окружающей среды (Н), dx – перемещение (м).
2. Работа по образованию новой поверхности под действием сил поверхностного натяжения - σ (двухмерная задача):
δА = - σ dΩ
где σ – коэффициент поверхностного натяжения (Н/м), dΩ – изменение площади поверхности (м2), знак минус отражает действие внутренних сил.
3. Работа расширения системы (рабочего тела) в пространстве под действием сил давления (трехмерная задача):
10
δL = р dV
где р – давление (Н/м2), dV – изменение объема системы (м3). Или в удельных величинах:
δl = р dv
Возможны и другие виды механических воздействий с различными движущими силами: изгиба, закручивания, гравитации, центробежными и др.
Для электрических воздействий - работа перемещения электрического заряда в электрическом поле:
δА = φ dq
где φ – потенциал электрического поля, dq – электрический заряд. Для химических и фазовых превращений:
δА = μ dm
где μ – химический потенциал, dm – изменение массы фаз или продуктов взаимодействия.
Для тепловых воздействий:
δQ = T dS |
(1.10) |
или в удельных величинах: |
|
δq = T ds |
(1.11) |
где T - температура (К), dS – изменение энтропии (кДж/К), ds – изменение удельной энтропии (кДж/кг.К).
Появление в науке энтропии, как тепловой координаты, вызывало определенные трудности. Эта характерная физическая величина непосредственно на опыте не измеряется и не наблюдается. Она может быть только вычислена через другие определяемые на опыте величины. (Аналогичные трудности были и с введением химического потенциала - μ). В настоящее время энтропия, как физический параметр, широко используется при описании физических и химических процессов как в науке, так и на практике.
11
1.2.Идеализации в термодинамике
Вобщем случае, любая термодинамическая система, за счет обмена энергией с окружающей средой, всегда является неравновесной и нестационарной и, прежде всего, в тепловом отношении. Неравновесность системы означает, что ее интенсивные параметры – потенциалы (температура, давление и пр.) неодинаковы по системе, что вызывает перенос энергии и вещества, т.е. нестационарность. По этой причине возникают сложности в описании состояния системы, требующие представлять локальные картины распределения параметров, что влечет за собой сложности и в описании и в расчетах процессах. Преодоление этих затруднений становится возможным за счет целого ряда идеализации – допущений и упрощений.
Состояние системы в любой момент времени принимается в термодинамике за равновесный, с одинаковыми значениями потенциалов по системе, что позволяет выразить в значительно более простой форме связь
между параметрами – уравнение состояния. Процессы при этом рассматриваются как переходы от одного состояния к другому и носят, в связи с этим, название равновесных процессов. Такая идеализация существенно упрощает и уравнения процессов.
Каждое равновесное состояние изображается точкой на диаграмме состояния. Термодинамический процесс, как непрерывная смена равновесных состояний изображается линией на диаграмме состояния (рис.1).
Если воздействие или изменение параметров бесконечно мало, процесс называется дифференциальным. В дифференциальном процессе все параметры процесса можно считать постоянными. Дифференциальное изменение параметров системы в математике называется полным дифференциалом dp, dv, dT, du и др. (рис.2). Величина полного дифференциала является однозначной при переходе от одного состояния к другому или от точке к точке на диаграмме состояния.
12

Рисунок 1.1 Изображение процесса на |
Рисунок 1.2 Дифференциалы параметров |
диаграмме р-v |
на диаграмме р-v |
Как было указано ранее, дифференциальные величины теплоты и работы не являются полными дифференциалами, это эффекты процесса и они могут иметь бесконечное множество значений при одном и том же изменении состояния системы; в соответствии с бесконечным многообразием внешних условий и для отличия от полных дифференциалов они обозначаются δq, δa, δl. Уравнения, куда входят эти величины, не могут интегрироваться как обыкновенные дифференциальные уравнения.
Энергетические взаимодействия также в значительной степени идеализируются. Например, уравнения теплового баланса не учитывают перехода части тепловой энергии в механическую энергию – работу расширения, часто этим пренебрегается. Расширение газа в цилиндре с поршнем вызывает переход части механической энергии в теплоту из-за трения, что также не учитывается. Характер и вид энергетического взаимодействия (например, подвод тепла теплопроводностью, конвекцией или излучением), скорости подвода или отвода энергии при таком подходе не рассматриваются и оцениваются только по изменению внутренних параметров системы или просто задаются величиной энергетического взаимодействия.
Равновесные процессы при такой идеализации рассматриваются как обратимые, т.е. обратное протекание их будет соответствовать тем же точкам промежуточного состояния, что были и у прямого процесса.
13
Уравнения процесса в этом случае будут одинаковы, энергетические эффекты будут равны и только противоположны по знаку. Такие равновесные обратимые процессы оказываются независящими и от скорости их протекания. Условиям обратимости должно соответствовать такое протекание процессов, при котором в любой момент времени устанавливается равновесное состояние, процесс рассматривается как «квазистатический».
Действительные процессы всегда оказываются неравновесными, поскольку состояния равновесия по всей системе не успевают устанавливаться. Всегда присутствующие явления: трения, теплообмена, диффузии и пр., вызывающие переходы разных форм энергии в теплоту и ее рассеивания, приводят к необратимости реальных процессов. Таким образом, обратное протекание процесса не будет проходить через те же состояния, что были у прямого процесса и энергетическая суть изменяется: например, работа при расширении будет всегда меньше работы, затрачиваемой на сжатие. Так в необратимом процессе расширения часть работы, полученной в процессе, идет на компенсацию необратимости
δL ≤ р dV |
(1.12) |
Знак равенства соответствует идеализированным |
равновесным |
процессам.
Однако введение предположений о равновесных обратимых процессах позволяет, существенно не влияя на правильность реальных процессов, упростить расчеты, не учитывать кинетику процесса - не включать параметр времени. Наиболее важные черты процесса предстают при этом наиболее отчетливо. Переход к реальным процессам может быть осуществлен введением в уравнения для равновесных процессов поправочных коэффициентов, учитывающих возникающее отклонение. Такой подход к рассмотрению и описанию процессов позволил сформировать науку как равновесную термодинамику.
Более глубокий анализ энергетики реальных процессов, учитывающий
14
кинетику, необратимость, условия взаимодействия полей и потоков вещества и энергии привел к развитию термодинамики необратимых процессов или
неравновесной термодинамики.
15
2.ПОЛИТРОПНЫЕ ПРОЦЕССЫ ИДЕАЛЬНОГО ГАЗА
2.1.Уравнение состояния и первый закон термодинамики
Втермодинамике для упрощения расчетов процессов и состояний газ рассматривается как идеальный, то есть принимается за систему материальных точек, не имеющих собственного объема молекул, между которыми отсутствуют силы взаимодействия.
Являясь рабочим телом, газ может воспринимать или отдавать теплоту, при этом он расширяется или сжимается. Таким образом, в этих процессах имеют место две формы энергии, присутствующие во всех случаях: тепловая и механическая.
Изучаемый объект, представляющий рабочее тело с определенными границами взаимодействия с окружающей средой, называют термодинамической системой, которая при наличии только тепловой и механической энергии является простейшей термомеханической системой. Часто, для понимания поведения такой системы и условий протекания процессов, ее представляют в виде газа, находящегося в цилиндре с подвижным поршнем.
Состояние термодинамической системы определяется некоторым количеством физических параметров, которые являются взаимозависимыми. Изменение одного из них ведет к изменению других. Функциональную зависимость между параметрами называют уравнением состояния. На основе изучения поведения газов и установленных газовых законов было получено уравнение, связывающее давление, объем, температуру и массу газа и носящее имя Клапейрона:
pV = mRT , |
(2.1) |
где р – давление , Па ; V – объем, м3 ; m – масса, кг ; |
R – газовая |
постоянная , Дж/кг оК ; Т – температура, оК. |
|
16
Записанное для одного килограмма газа оно позволяет рассчитывать плотность
газа при заданных параметрах состояния |
|
pv = RT , |
(2.2) |
ρ = 1/v = р/RT , |
(2.3) |
где v – удельный объем газа, м3/кг ; ρ - плотность, кг/м3. |
|
Менделеев расширил рамки уравнения состояния, введя универсальную газовую постоянную Rμ для одного моля или киломоля и являющуюся одинаковой для всех газов или газовых смесей и равную 8315 Дж/кмоль оК или 8,315 кДж/кмоль оК.
С универсальной газовой постоянной уравнение Менделеева-Клапейрона
записывается так: |
|
pV = m/μ ∙ RµT , |
(2.4) |
где μ - молярная масса газа, кг/кмоль. |
|
Отсюда: |
|
R = Rµ / μ |
(2.5) |
Уравнение состояния идеального газа отражает и известную взаимосвязь |
|
параметров, называемую уравнением объединенного |
газового закона |
p1V1/T1 = p2V2/T2 , |
(2.6) |
позволяющую устанавливать изменение параметров при протекании процессов. Процесс в термодинамической системе может возникнуть только тогда, когда на неё оказывают внешнее энергетическое воздействие. Для простейшей - термомеханической системы в форме теплоты (Q, Дж) или работы (L, Дж) энергетическая суть выражается законом сохранения энергии, называемым также первым законом термодинамики и представляющим энергетический
баланс.
Для термомеханической системы он показывает, что подведенное |
тепло |
|
может идти на изменение внутренней энергии системы ( U , Дж |
) |
и на |
совершение работы: |
|
|
δQ = dU + δL , |
|
(2.7) |
17
или в удельных величинах |
|
δq = du + δl , |
(2.8) |
или в интегральной форме |
|
Q = U + L |
(2.9) |
Любой вид энергетического воздействия определяется своей парой параметров – потенциалом и координатой (интенсивным и экстенсивным факторами), которые являются в то же время и параметрами термодинамической системы. Разность потенциалов является движущей силой процесса, а изменение координаты отражает наличие энергетических воздействий данного рода. Так, механическое деформационное воздействие, то есть процессы сжатия или расширения, выразятся через давление, как потенциал, и объем, как экстенсивную величину – координату. Произведение потенциала на изменение координаты дает величину энергетического воздействия, которое может быть выражено в диаграмме состояния в виде площади под линией процесса:
|
δL = pdV ; |
δl = pdv |
(2.10) |
или в интегральной форме |
2 |
2 |
|
|
L = ∫ pdV=m·l =m ∙ ∫ pdv |
(2.11) |
|
|
1 |
1 |
|
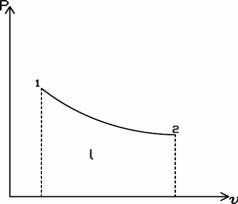
Диаграмма р - v в связи с этим носит название рабочей диаграммы :
Рисунок 2.1 Рабочая диаграмма р - v
Работа расширения принимается положительной по знаку, работа сжатия – отрицательной. В зависимости от условий протекания процесса величина работы меняется, то есть работа есть функция
процесса.
18

Для теплового воздействия потенциалом является температура, а координатой (экстенсивной величиной, отражающей тепловые изменения)- энтропия (S, Дж/К). Количество подведенного или отведенного тепла к системе выразится как
δQ = TdS ; |
δq = Tds, |
(2.12) |
или в интегральной форме |
|
|
2 |
2 |
|
|
|
|
Q=∫ TdS = m· q=m ∙∫ Tds, |
(2.13) |
|
1 |
1 |
|
и может быть представлено в диаграмме Т - s, называемой тепловой диаграммой в виде площади под линией процесса.
T
|
|
Рисунок 2.2 Тепловая диаграмма Т – s |
|
|||
|
|
2 |
|
|
|
|
|
|
Подведенное |
тепло |
принимается |
||
1 |
|
положительным |
по |
знаку, |
отведенное- |
|
|
|
|
|
|
|
|
|
|
отрицательным. |
Как |
и работа, |
теплота |
|
|
q |
является функцией процесса, то есть её |
||||
|
|
|||||
|
|
S величина изменяется в зависимости от |
||||
условий проведения процесса. Поскольку практическое определение |
энтропии |
|||||
или её изменений при протекании процессов |
до |
настоящего |
времени |
|||
технически оказывается не достижимым, расчеты теплоты производятся через
удельную теплоту – теплоемкость |
(с, Дж/кгоК |
) по калориметрическому |
уравнению: |
|
|
dQ = mcdT |
(2.14) |
|
Теплоемкость, зависящая от природы вещества и представляющая |
||
количество тепла необходимое для |
нагрева единицы массы вещества (кг) |
|
на один градус (оС , оК), как и сама теплота, является функцией процесса, то есть может принимать для газов различные значения от - ∞ до + ∞ в
19
