
- •Министерство здравоохранения Республики Беларусь Учреждение образования «Гомельский государственный медицинский университет»
- •Поджелудочная железа человека представляет собой удлинённое дольчатое образование серовато-розоватого оттенка и расположена в
- •Эндокринная часть поджелудочной железы образована лежащими между ацинусов панкреатическими островками, или островками Лангерганса
- •Инсулин представляет собой простой полипептид с молекулярной массой около 6000, состоящий из двух
- •СИНТЕЗ ИНСУЛИНА
- •Из аминокислот на секрецию гормона наиболее значительно влияют лизин и аргинин. Но сами
- •Нервная регуляция β-клеток поджелудочной железы включает адренергическую и холинергическую регуляцию. Любые стрессы (эмоциональные
- •Стимуляция секреции инсулина
- •Связывание инсулина с рецептором инициирует ферментативный каскад реакций фосфорилирования. Первым делом аутофосфорилируются тирозиновые
- •Биологические эффекты инсулина подразделяются по скорости развития:
- •Быстрые эффекты (минуты)
- •Медленные эффекты (минуты-часы)
- •Инсулин выполняет в организме следующие основные функции:
- •В состав полипептидной цепи глюкагона входит 29 аминокислотных остатков, его молекулярная масса 4200,
- •Физиологическая роль пептидов — предшественников глюкагона не ясна, однако сложная регуляция процессинга препроглюкагона
- •Регулируемым параметром в контуре регуляции секреции глюкагона является концентрация глюкозы. Уменьшение ее в
- •1 - глюкагон и адреналин взаимодействуют со специфическими мембранными рецепторами. Комплекс гормон-рецептор влияет
- •Глюкагон увеличивает содержание глюкозы (способствует гипергликемии) в плазме крови. Этот эффект реализуется несколькими
- •Соматостатин – пептид из 12 аминокислот, он образуется также в островках поджелудочной железы
- •Основные этапы генно-инженерного синтеза соматостатина показаны на опыте. Синтетический ген соматостатина был встроен
- •В настоящее время доказаны следующие влияния соматостатина:
- •Гиперинсулинизм — клинический синдром, характеризующийся повышением уровня инсулина и снижением сахара в крови.
- •Панкреатическая форма болезни встречается при злокачественных или доброкачественных новообразованиях, а также гиперплазии бета-клеток
- •1. Первичный
- •2.Вторичный
- •Клиническая картина гипогликемической болезни обусловлена понижением уровня глюкозы в крови. Развитие приступа начинается
- •Диагностика основывается на клинической картине (потеря
- •Гипоинсулинизм дефицит инсулина в организме, связанный либо с недосточной секрецией этого гормона поджелудочнойжелезой,
- •Недостаток гормона разделяют на 2 категории:
- •Саа́харный диабеа́т 1-го типа
- •Основополагающие причины сахарного диабета 1 типа заключаются в генетической предрасположенности. Примечательно то, что
- •Несмотря на то, что сахарный диабет 1 типа, как классическое аутоиммунное заболевание, известно
- •Выделяют 6 стадий развития сахарного диабета первого
- •Сахарный диабет 2-го типа (инсулиннезависимый диабет) — метаболическое заболевание, характеризующееся хронической гипергликемией, развивающейся
- •2.Генетическая предрасположенность. Ученые давно установили, что в развитии заболевания особую роль играет наследственность.
- •Признаки сахарного диабета 2 типа неспецифичны и
- •. По степени тяжести:
- •Лечение диабета 2-го типа начинают с назначения диеты и умеренной физической нагрузки. На
- •В человеческом организме процессы обмена веществ представляют собой очень сложные функции, которые состоят
- •Спасибо за внимание!

Министерство здравоохранения Республики Беларусь Учреждение образования «Гомельский государственный медицинский университет»
Кафедра Общей, биоорганической и биологической химии
Управляемая самостоятельная работа студента По теме:
Поджелудочная железа. Инсулин, глюкагон, соматостатин. Диабет 1-го типа и диабет 2-го типа. Причины возникновения, сравнительная характеристика
Выполнили студентки группы Л-231 Специальность «Лечебное дело» Шифр специальности 1-79 01 01 Козловская Татьяна Владимировна Повчиник Дарья Анатольевна
Гомель, 2018 Проверила ассистент кафедры Скрыпникова Любовь Петровна
Поджелудочная железа человека представляет собой удлинённое дольчатое образование серовато-розоватого оттенка и расположена в брюшной полости позади желудка, тесно примыкая к двенадцатиперстной кишке. Орган залегает
вверхнем отделе на задней стенке полости живота
взабрюшинном пространстве, располагаясь поперечно на уровне тел I—II поясничных позвонков. Длина железы взрослого человека — 14—22 см, ширина — 3—9 см (в области
головки), толщина — 2—3 см. Масса органа — около 70—80 г. Поджелудочная железа характеризуется
альвеолярно-ацинозным строением, состоит из многочисленных долек, отделённых друг от друга прослойками соединительной ткани. Каждая долька складывается из секреторных эпителиальных клеток разнообразной формы: треугольной, округлой и цилиндрической. В этих клетках образуется панкреатический сок.

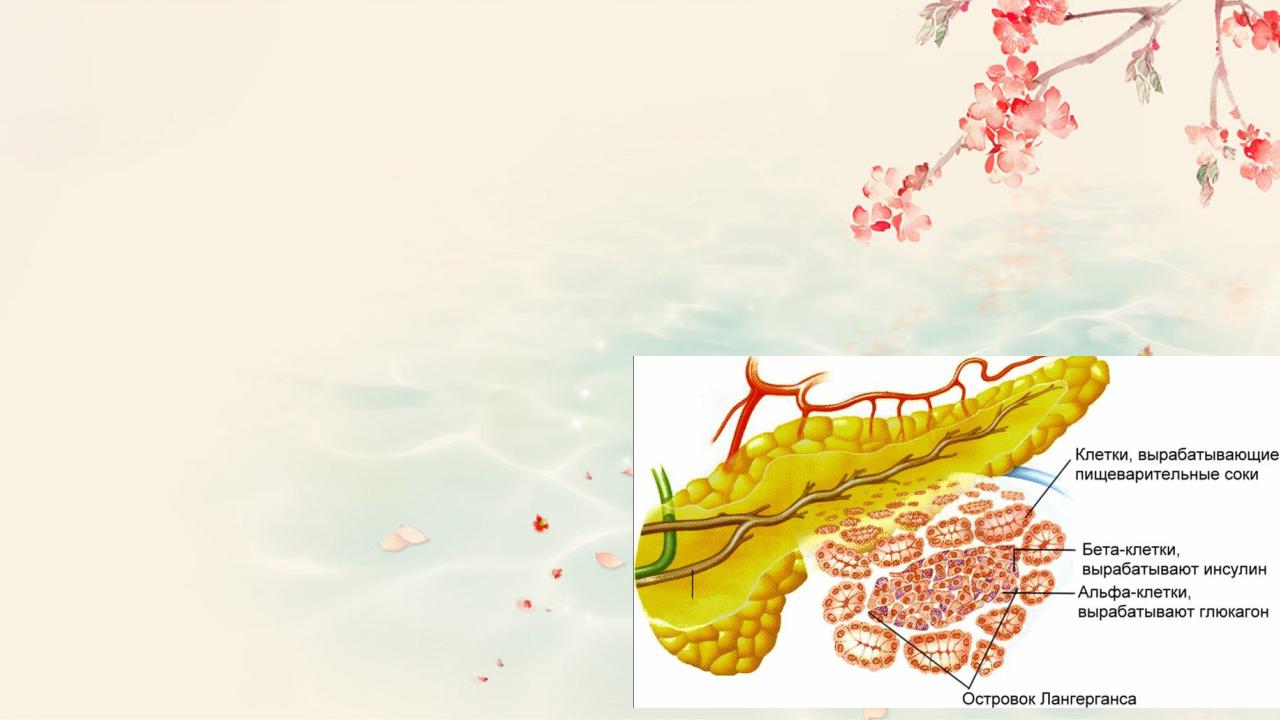
Эндокринная часть поджелудочной железы образована лежащими между ацинусов панкреатическими островками, или островками Лангерганса - светлыми образованиями размером 50— 500 мкм, состоящими из разных типов эпителиальных клеток (альфа-, бета-и дельта-клеток). Островки составляют около 1,5% объема железы; у человека их насчитывается около 1 млн. Островки состоят из клеток – инсулоцитов, среди которых на основании наличия в них различных по физико-химическим и морфологическим свойствам гранул выделяют 5 основных видов:
-бета-клетки, синтезирующие инсулин (60—80 %);
-альфа-клетки, продуцирующие глюкагон (20 %);
-дельта-клетки, образующие соматостатин;
-D1-клетки, выделяющие ВИП;
-PP-клетки, вырабатывающие ПП.
Кроме того, методами иммуноцитохимии и электронной микроскопии было показано наличие в островках незначительного количества клеток, содержащих гастрин, тиролиберин и соматолиберин.

Инсулин представляет собой простой полипептид с молекулярной массой около 6000, состоящий из двух линейных цепей: А — с 21 аминокислотой и В — с 30 аминокислотами, соединенных двумя бисульфидными мостиками. В цепи А есть еще один «внешний» бисульфидный мостик. В настоящее время принята точка зрения, согласно которой вначале синтезируется одна цепь аминокислот с последующим свертыванием молекулы и образованием бисульфидных связей. В этом процессе участвует так называемый соединительный пептид, или пептид С, состоящий из 33 аминокислот и соединяющий цепи А и В. После свертывания образуется предшественник инсулина, или проинсулин, с Биологическаямолекулярной массойактивностьсвышепроинсулина9000. составляет примерно 10% активности инсулина. Соединительный пептид С отщепляется от инсулина в гранулах β-клеток перед секрецией в кровь и поступает в нее в количестве, эквимолекулярном инсулину. Определение уровня пептида С является более надежным индикатором секреции β- клеток, чем определение собственно инсулина, так как последний в отличие от С-пептида частично задерживается в печени, может подвергаться воздействию циркулирующих противоинсулиновых антител и подвергаться другим воздействиям, искажающим истинную картину. Разъединение цепей А и В приводит к
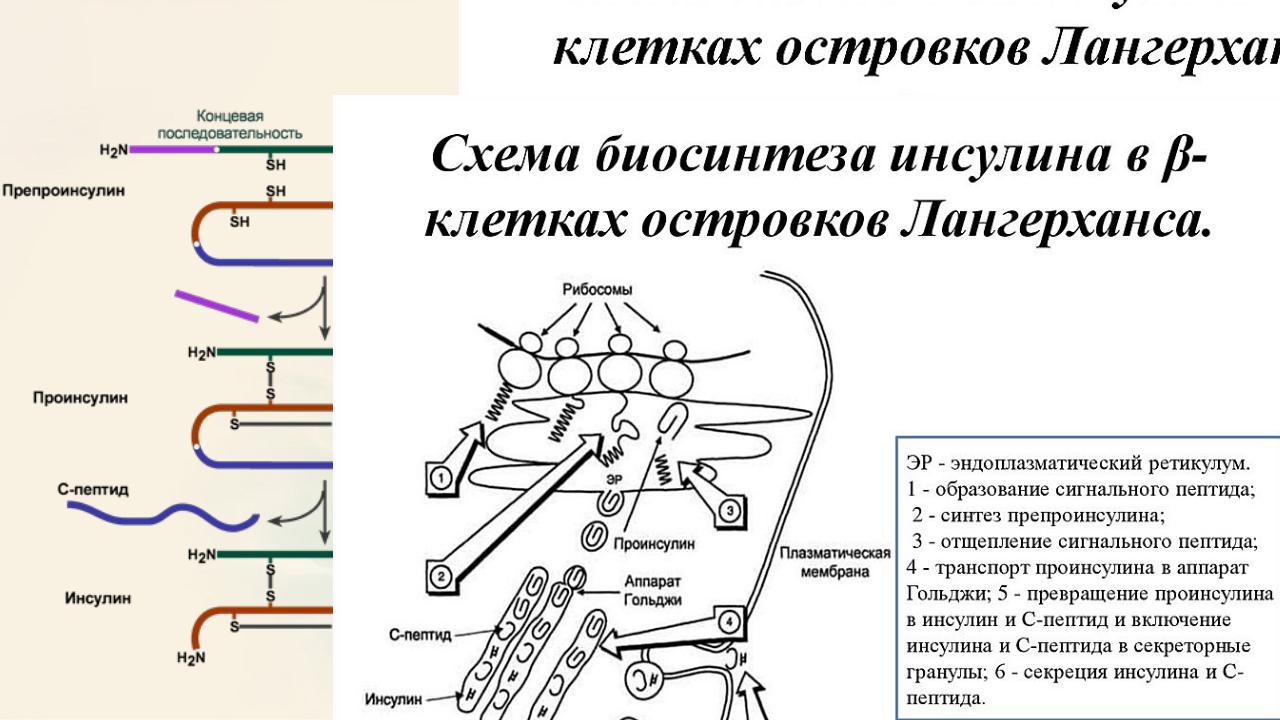
СИНТЕЗ ИНСУЛИНА

Из аминокислот на секрецию гормона наиболее значительно влияют лизин и аргинин. Но сами по себе они почти не стимулируют секрецию, их эффект зависит от наличия гипергликемии, т.е. аминокислоты только потенциируют действие глюкозы.
Свободные жирные кислоты также являются факторами, стимулирующими секрецию инсулина, но тоже только в присутствии глюкозы. При гипогликемии они оказывают обратный эффект, подавляя экспрессию гена инсулина.
Логичной является положительная чувствительность секреции инсулина к действию гормонов ЖКТ– инкретинов (энтероглюкагона и глюкозозависимого инсулинотропного
полипептида), холецистокинина, секретина, гастрина, Ж ИП.
Клинически важным и в какой-то мере опасным является усиление секреции инсулина при длительном воздействии соматотропного
гормона, АКТГ и глюкокортикоидов, эстрогенов, прогес тинов. При этом возрастает риск истощения β-клеток, уменьшение синтеза инсулина и возникновение инсулинзависимого сахарного диабета. Такое может наблюдаться при использовании указанных гормонов в
терапии или при патологиях, связанных с их

Нервная регуляция β-клеток поджелудочной железы включает адренергическую и холинергическую регуляцию. Любые стрессы (эмоциональные и/или физические нагрузки,
гипоксия, переохлаждение, травмы, ожоги) повышают активность симпатической нервной системы и подавляют секрецию инсулина за счет активации α2-адренорецепторов. С другой стороны, стимуляция
β2-адренорецепторов приводит к усилению секреции.
Также выделение инсулина контролируется n.vagus, в свою очередь находящегося под контролем гипоталамуса, чувствительного к концентрации глюкозы крови.
Главным стимулятором секреции инсулина является повышение концентрации глюкозы в крови выше 5,5 ммоль/л, максимума секреция достигает при 17-28 ммоль/л. Особенностью этой стимуляции является двухфазное усиление секреции инсулина:
•первая фаза длится 5-10 минут и концентрация гормона может 10-кратно возрастать, после чего его количество понижается,
•вторая фаза начинается примерно через 15 минут от начала гипергликемии и продолжается на протяжении всего ее периода, приводя к увеличению уровня гормона в 15-25 раз.
Чем дольше в крови сохраняется высокая концентрация

Стимуляция секреции инсулина
1.После проникновения глюкозы в β-клетки (через ГлюТ-1 и ГлюТ-2) она фосфорилируется гексокиназой IV (глюкокиназа, обладает низким сродством к глюкозе)
2.Далее глюкоза аэробно окисляется, при этом скорость окисления глюкозы линейно зависит от ее количества,
3.В результате нарабатывается АТФ, количество которого также прямо зависит от концентрации глюкозы в крови,
4.Накопление АТФ стимулирует закрытие ионных K+-каналов, что приводит к деполяризации мембраны,
5.Деполяризация мембраны приводит к открытию потенциал-зависимых Ca2+-каналов и притоку ионов Ca2+ в клетку,
6.Поступающие ионы Ca2+ активируют фосфолипазу C и запускают кальций- фосфолипидный механизм проведения сигнала с образованием ДАГ и инозитол- трифосфата,
7.Появление инозитол-трифосфата в цитозоле открывает Ca2+-каналы в эндоплазматической сети, что ускоряет накопление ионов Ca2+ в цитозоле,
8.Резкое увеличение концентрации в клетке ионов Ca2+ приводит к перемещению секреторных гранул к плазматической мембране, их слиянию с ней и экзоцитозу кристаллов зрелого инсулина наружу,
9.Далее происходит распад кристаллов, отделение ионов Zn2+ и выход молекул активного инсулина в кровоток.
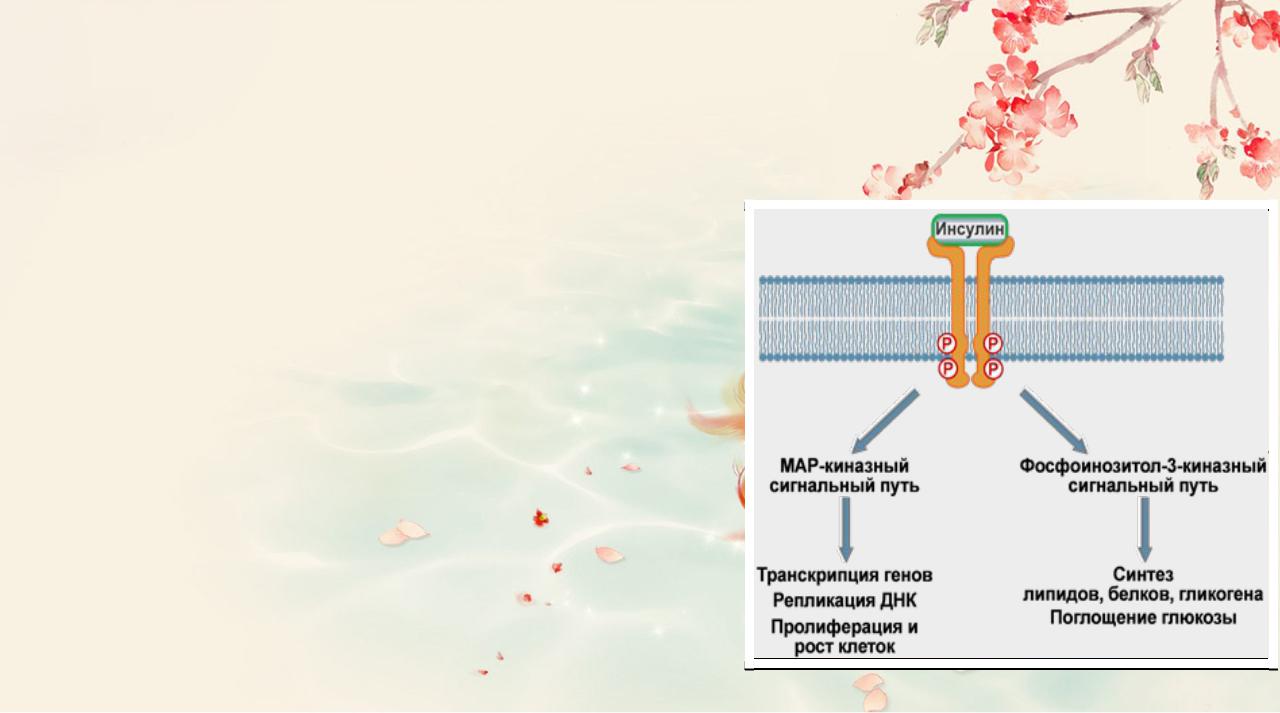
Связывание инсулина с рецептором инициирует ферментативный каскад реакций фосфорилирования. Первым делом аутофосфорилируются тирозиновые остатки на внутриклеточном домене самого рецептора. Это активирует рецептор и ведет
кфосфорилированию остатков серина на особом белке, называемом субстрат инсулинового рецептора (СИР, или чаще IRS от англ. insulin receptor substrate). Таких IRS выделяют четыре типа – IRS 1, IRS 2, IRS 3, IRS 4. Также
ксубстратам инсулинового рецептора относят белки Grb- 1 и Shc, которые отличаются от IRS аминокислотной последовательностью.
Дальнейшие события разделяются по двум направлениям:
1.Реакции, связанные с активностью ферментов MAP- киназ – в целом управляют активностью хроматина.
2.Процессы, связанные с активацией фосфоинозитол-3- киназы – в основном контролируют метаболические реакции. Сюда же относятся процессы, которые регулируют активность глюкозных транспортеров и
поглощение глюкозы клетками.
Тем не менее, такое подразделение условно, так как в клетке присутствуют ферменты, чувствительные к активации и того и другого каскадного пути.

Биологические эффекты инсулина подразделяются по скорости развития:
Очень быстрые эффекты (секунды)
Эти эффекты связаны с изменением трансмембранных транспортов:
1.Активации Na+/K+-АТФазы, что вызывает выход ионов Na+ и вход в клетку ионов K+, что ведет
к гиперполяризации мембран чувствительных к инсулину клеток (кроме гепатоцитов).
2.Активация Na+/H+-обменника на цитоплазматической мембране многих клеток и выход из клетки ионов H+ в обмен на ионы Na+. Такое влияние имеет значение в патогенезе артериальной гипертензии при сахарном диабете 2 типа.
3.Угнетение мембранной Ca2+-АТФазы приводит к задержке ионов Ca2+ в цитозоле клетки.
4.Выход на мембрану миоцитов и адипоцитов переносчиков глюкозы ГлюТ-4 и увеличение в 20-50 раз объема транспорта глюкозы в клетку.
