
Mikrobiologia_praktika
.pdf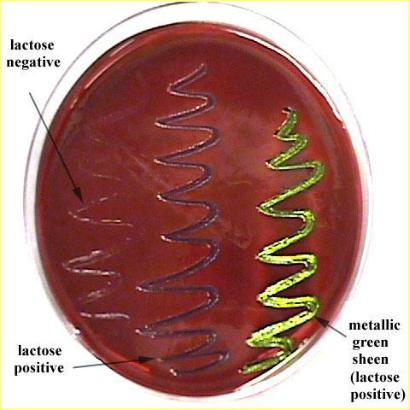
Дифференциально-диагностические питательные среды
Среда Левина содержит К2НРО4 (гидроортофосфат калия), метиленовый синий и эозин. В англоязычной литературе более употребительное название для этой среды “Eosin Methylene Blue Agar”, иногда – “Eosin Methylene Blue Agar (Levine)”.
•Лактозо-положительные колонии на среде Левина – насыщенного синего цвета.
•Лактозо-отрицательные колонии на среде Левина бесцветные.
9. Методы вирусологических исследований
•Вирусоскопическое исследование позволяет обнаружить характерные вирусные включения, а электронная микроскопия - сами вирионы, и по особенностям их строения диагностировать соответствующую инфекцию (например, ротавирусную).
•Вирусологическое исследование направлено на выделение вируса и его идентификацию. Для выделения вирусов используют заражение лабораторных животных, куриных эмбрионов или культуры тканей.
9. Методы вирусологических исследований
Индикация вирусов - лабораторный процесс установления присутствия неидентифицированных вирусов в исследуемом материале или в системе культивирования вирусов. Наличие вируса устанавливается:
•По характеру специфических поражений оболочек и тела эмбриона
•По феномену гемагглютинации
•По цитопатическому действию вируса
•По образованию в клетках включений
•По образованию бляшек
•По феномену гемадсорбции
•По цветной реакции
9. Методы вирусологических исследований
Первичную идентификацию выделенного вируса до уровня семейства можно провести с помощью:
-определения типа нуклеиновой кислоты (проба с бромдезоксиуридоном),
-особенностей ее строения (электронная микроскопия),
-размером вириона (фильтрование через мембранные фильтры с порами диаметром 50 и 100 нм),
-наличия суперкапсидной оболочки (проба с эфиром),
-гемагглютининов (реакция гемагглютинации),
-типа симметрии нуклеокапсида (электронная микроскопия).
9. Методы вирусологических исследований
Для диагностики вирусных инфекций широкое применение нашли методы иммунодиагностики (серодиагностики и иммуноиндикации). Они реализуются в самых разнообразных реакциях иммунитета:
•радиоизотопный иммунный анализ (РИА),
•иммуноферментный анализ (ИФА),
•реакция иммунофлюоресценции (РИФ),
•реакция связывания комплемента (РСК),
•реакция пассивной гемагглютинации (РПГА),
•реакции торможения гемагглютинации (РТГА) и другие.
10, 11. Культивирование анаэробов
Методы создания анаэробных условий
1. Физичесикие методы. Для удаления растворенного в питательных средах кислорода используют их регенерацию путем кипячения в течение 15-20 минут на водяной бане с последующим быстрым охлаждением до 50 градусов. После посева поверхность среды заливают парафином или вазелиновым маслом. Так же, возможен посев в столбик плотной или полужидкой среды на глубину 10-12см. кислород с воздуха диффундирует на 1,5-2см, а в глубине создаются благоприятные условия. Применение анаэростатов и анаэробных боксов.
2.Химические методы. Для поглощения кислорода из замкнутого простанства можно использовать гидросульфит натрия. Для связывания кислорода в 1л объема используют 100мл свежеприготовленного 20% Na2S2O4 и 16мл 50% КОН. Для связывания остатков кислорода используют вещества-редуценты, к которым относится тиогликоевая кислота или тиогликолат натрия, аскорбиновая кислота, различные сахара, цистин и цистеин, муравьинокислый натрий и т.д.
3.Биологические методы. Совместнео выращиевание анаэробов и аэробов (метод Фортнера). При нем на одну половину чашку засевают исследуемы материал, а на другую – культуру аэробного или факультативно-анаэробного микроба, способного энергично поглощать кислород. Помещение в среду кусочков печени, почек, мозга. При это тканевые клетки активно поглощают и адсорбируют кислород, а в среде создаются анаэробные условия.
10, 11. Культивирование анаэробов
Питательные среды, на которых выращивают анаэробы, по своему составу аналогичны обычным средам. Отличаются лишь тем, что они сами по себе должны создавать анаэробные условия. С этой целью питательные среды разливаются высоким столбиком, до посева жидкие среды кипятят для удаления из них кислорода, а на их поверхность наслаивают вазелиновое масло для изоляции от атмосферного кислорода. Кроме этого в состав питательных сред входят различные редуцирующие вещества, уменьшающие содержание в них свободного кислорода. В качестве редуцирующих веществ обычно используют глюкозу (1-2%-ную), муравьинокислый натрий 0,3-0,5%- ный и пр. Часто в жидкие питательные среды опускают какие-либопористые вещества (кусочки тканей, пемзу, вату), которые адсорбируютна своей поверхности воздух.
Для выделения анаэробных бактерий из патологического материала, а также для их накопления и сохранения используют жидкую питательную среду Китта-Тароцци (мясо-пептонный печеночный бульон — МППБ). В состав МППБ входит печеночный экстракт с МПБ (1:1), который разливают по
пробиркам высоким столбиком. На дно пробирки предварительно помещают
кусочки вареной печени, а сверху после разлива среды наслаивают вазелиновое масло.
10, 11. Культивирование анаэробов
•В ряде случаев к МППБ добавляют стерильный раствор глюкозы в количестве 0,5 % (в пересчете на сухое вещество).
•Для дифференциации патогенных анаэробов используют среды: кровяной агар Цейсслера, сахарный МПА, молоко, железо-сульфатный агар (среда Вильсона-Блера) и др.
•Кровяной агар (Цейсслера): 3%-ный мясо-пептонный агар с 1-2 % глюкозы, смешивают (при температуре 50 °С) с 15-20 % свежей де-фибринированной крови барана, крупного рогатого скота, лошади.
•Пользуются также кровью кролика или морской свинки, добавляя ее в количестве 5-7 %. Питательную среду разливают по чашкам Петри и подсушивают в термостате 20-30 мин. После посева культуры выращивают в анаэробных условиях.
•Сахарный агар готовят на бульоне Мартена с добавлением 0,1 % глюкозы и 2 % агар-агара.
•Молоко обезжиривают и разливают по пробиркам высоким столбиком и сверху наслаивают вазелиновое масло.
•Железо-сульфитный агар (Вильсона-Блера). К 100 мл 3%-ного МПАс 10% глюкозы прибавляют 10 мл 20%-ного раствора сульфита натрия и 1 мл 8%-ного раствора хлорида железа. Черные колонии образуют анаэробные бактерии за счет восстановления сульфита натрия в сульфат натрия, который, соединяясь с хлорным железом, образует черный осадок сульфида железа.
10, 11. Культивирование анаэробов
•Методы выделения чистых культур анаэробов.
•Метод Цейсслера. Исследуемый материал сеют штрихами по поверхности плотной среды. Создают анаэробные условия. И инкубируют при 37 градусах 24-72ч. Изолированные колонии анаэробов пересевают на среду контроля стерильности или среду Китта-Тароцци.
•Метод Вейнберга. Несколько капель исследуемого материал вносят в пробирку с 4-5мл изотонического раствора. Перемешивают запаянным капилляром переносят в пробирку с охлажденным до 45-50 градусов сахарным агаром, разлитым высоким столбиком. После перемешивания этим же капилляром засевают еще две пробирки с сахарным агаром и быстро охлаждают под струей воды. Выросшие в глубине колонии пересевают на СКС или среду КиттаТароцци.
•Метод Перетца. Готовят разведение материала, как указано выше. Содержимое пробирки с соответствующим разведением выливают в чашку Петри, на дне которой на двух палочках лежит стеклянная пластина 6х6см. среду заливают так, что бы она заполнила пространство между пластиной и дном чашки. При появлении роста пластинку поднимают и чистые колонии пересевают.
10, 11. Культивирование анаэробов
•Метод Фортнера – посев аэробов и анаэробов на одну среду, которая заливается вазелином. Инкубация. Сначала рост аэробов, затем их гибель. Рост анаэробов.
