
- •Термохимия
- •Описание устройства калориметра
- •Определение постоянной калориметра
- •Обработка результатов калориметрических измерений и проведение расчетов
- •Определение теплоты растворения соли в воде
- •Определение теплоты реакции нейтрализации
- •Определение теплоты образования кристаллогидрата
- •Химическое равновесие
- •Определение констант равновесия реакции комплексообразования
- •Определение константы устойчивости
- •Результаты измерений оптической плотности
- •Изучение зависимости константы устойчивости комплекса от температуры
- •Температурная зависимость константы устойчивости
- •Влияние температуры на равновесие в системе жидкость - пар
- •Порядок работы на установке
- •Зависимость температуры кипения жидкости от давления
- •Обработка экспериментальных данных
- •Электрохимия растворов электролитов
- •Электропроводность растворов электролитов
- •Порядок работы на кондуктометре «Эксперт-002»
- •Определение константы сосуда
- •Определение константы диссоциации органической кислоты
Зависимость температуры кипения жидкости от давления
|
Температура кипения жидкости |
1/Т |
Показания вакуумметра |
Давление насыщенного |
lnp | |
|
t, 0С |
T, К |
|
p(дел. шкалы) |
пара p = 100 - p(дел. шкалы) |
|
|
|
|
|
|
|
|
|
... |
... |
... |
... |
... |
... |
|
|
|
|
|
|
|
Обработка экспериментальных данных
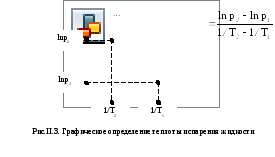
Для расчета энтальпии испарения строят график, откладывая на оси абсцисс 1/T, а на оси ординат – ln p. Проводят проверку выполнимости уравнения Клапейрона-Клаузиуса (см. (II.8) в [2]): если уравнение выполняется, то график должен получиться линейным (зависимость II.10 в [2]). Проведя через нанесенные экспериментальные точки прямую, находят тангенс угла наклона этой прямой к оси абсцисс (см.рис.II.3), или проводят обработку по методу наименьших квадратов. При измерении длин катетов необходимо учитывать масштабы по осям координат. По величине tgможно найти энтальпию испаренияvH:
![]() ,
,
где R=8,314 Дж/(моль.К).
Откуда vH=R.tg, Дж/моль.
Энтальпию испарения жидкости, найденную экспериментально vHэксп., следует сравнить с теоретическим значением, рассчитанным по справочным данным [1]:vHсправ. = fH(пар) fH(ж), и найти относительную погрешность эксперимента по формуле:
![]() .
(II.0)
.
(II.0)
Энтропию испарения жидкости находят по формуле (II.7) в [2], в которой энтальпия фазового перехода (индексtr) – найденная энтальпия испарения (индексv)trН = vH, а температура фазового перехода – температура кипения исследуемой жидкости при атмосферном давлении.
Как и для энтальпии испарения, находят относительную погрешность экспериментального определения энтропии испарения исследуемой жидкости, по формуле аналогичной (II.5).
При защите работы следует сделать выводы:
О выполнимости уравнения Клапейрона-Клаузиуса.
О значениях термодинамических характеристик (о чем говорят их абсолютные значения и чем объясняются их знаки?) и погрешностях их определения.
Сравнить термодинамические характеристики исследуемой жидкости со справочными характеристиками других жидкостей, например, ацетона и метанола, и если они отличаются, то объяснить причины этих различий. Сравнить энтропии испарения со значением, определяемым правилом Трутона.
Электрохимия растворов электролитов
Электропроводность растворов электролитов
Цель работы:определение методом электропроводности константы диссоциации слабой кислоты,
Реактивы: раствор слабой кислоты, дистиллированная вода.
Оборудования: термостат, сосуд для измерения сопротивления растворов, колба для дистиллированной воды, пипетка, стеклянная палочка, кондуктометр «Эксперт-002».
Порядок выполнения работы:
Для определения удельной электропроводности растворов (см. определение удельной электропроводности в теоретической части) не требуется иметь электроды площадью 1м2, расположенные на расстоянии 1 м друг от друга. Можно пользоваться любым сосудом с жестко фиксированными электродами. При работе с таким прибором необходимо определить постоянную сосуда (k) – отношение расстояния между электродами к площади их поверхности:
![]() (м-1) (IV.0)
(м-1) (IV.0)
Используя постоянную сосуда легко рассчитать в дальнейшем удельную, а затем и мольную электропроводность исследуемых растворов:
0=k=k/R,C=0/C, (IV.0)
где С - в моль/м3.
Датчики современных приборов, таких как кондуктометр «Эксперт‑002», уже откалиброваны, поэтому Вам не придется определять постоянную сосуда. Прибор автоматически рассчитает значение удельной электропроводности.
Сосуд для определения электропроводности предварительно тщательно моют и высушивают изнутри фильтровальной бумагой. Датчик между измерениями высушивают прикладыванием фильтровальной бумаги. Его нельзя класть на стол. Следует подкладывать лист фильтровальной бумаги. Объем раствора в сосуде должен быть одинаковым в каждом опыте.
Сосуд для определения электропроводности с раствором помещают в термостат и не вынимают из него до конца измерений. Перед началом измерений сосуд и раствор должны принять температуру термостата, для чего потребуется приблизительно 15 минут. При погружении сосуда в термостат уровень воды в термостате должен быть выше уровня раствора. В этот же термостат помещают колбу с дистиллированной водой, которую используют для разбавления исследуемых растворов.
